
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Феномен инактивации хромосомы Х
Х-инактивация – эпигенетический феномен, при помощи которого достигается транскрипционное «молчание» большинства генов на одной из двух хромосом Х в соматических клетках у женщин. Эпигенетические процессы представляют собой наследуемые изменения в экспрессии генов без количественного или качественного изменения последовательности ДНК [Юров и др., 2007]. Феномен Х-инактивации впервые был описан М.Лайон в 1961 г. [Lyon, 1961].
В раннем периоде эмбрионального развития женщины в каждой ее клетке активны обе хромосомы Х. Однако затем одна из двух хромосом Х (материнского или отцовского происхождения) инактивируется, что в дальнейшем наследуется всем потомством эмбриональной клетки. Таким образом, в женском организме одновременно существуют две популяции клеток, в каждой из которых экспрессируются гены разных хромосом Х: в одних – материнского, в других – отцовского происхождения. В среднем вклад каждой родительской хромосомы должен составлять 50 %, но поскольку процесс Х-инактивации носит случайный характер, то этот вклад может значительно варьировать [Belmont, 1996].
Исследования молекулярных механизмов Х-инактивации продемонстрировали значительную роль некодирующей XIST-РНК в этом
процессе. Ген XIST (X inactivation-specific transcript) картирован на хромосоме Х в участке Xql3.3 и кодирует ядерную РНК длиной около 17 тыс. пн, транскрипция которой осуществляется исключительно с неактивной хромосомы Х [Rinčić et al., 2016]. Экспрессия XIST во время эмбрионального развития инициирует каскад событий, которые в диплоидных клетках приводят к инактивации хромосомы Х, кроме одной, остающейся активной. XIST-РНК связана с хроматином хромосомы Х и ядерным матриксом вокруг инактивируемой хромосомы Х, «покрывая» последнюю, что ведет к изменениям структуры хроматина и пространственной организации этой хромосомы [Chow, Heard, 2009]. Вопреки существовавшему ранее мнению о проявлении Х-инактивации после имплантации эмбриона человека, последними исследованиями показано, что Х-инактивация инициируется еще до имплантации. Так, на одной из двух хромосом Х у эмбриона женского пола уже на стадии 8 клеток обнаружена аккумуляция XIST–РНК, которую можно наблюдать на стадиях морулы и бластоциста [van den Berg, Laven, 2009]. Х-инактивация ведет к наличию единственной функционально активной хромосомы Х в соматических клетках у обоих полов и существованию клеточного мозаицизма по различным активным хромосомам Х у женщин.
В каждой клетке существует лишь один набор активных Х-сцепленных генов. Участки, которые являются идентичными по генному составу для обеих половых хромосом, носят название псевдоаутосомных регионов (PAR1 и PAR2) и содержат как минимум 29 генов. PAR1, размером 2,7 млн пн, расположен в терминальном участке Xp, а PAR2, размером 0,33 млн пн, расположен в терминальной части Xq. Именно в псевдоаутосомных регионах возможен кроссинговер между половыми хромосомами X и Y. Вне псевдоаутосомных регионов рекомбинация специфичных для пола аллелей подавляется, и, следовательно, участки за пределами PAR накапливают мутации (чаще всего – делеции), и постепенно утрачиваются на половой хромосоме, характерной для гетерогаметного пола, т.е. у млекопитающих и человека – на хромосоме Y. Потеря генов хромосомы Y ведет к тому, что, во-первых, большинство Х-сцепленных генов присутствует только в количестве одной копии у гетерогаметного пола (XY), что нарушает их баланс по сравнению с аутосомными генами; во-вторых, Х-сцепленные гены присутствуют в количестве двух копий у гомогаметного пола (XX), что означает неэквивалентность их дозы между двумя полами [Migeon, 2007]. Ряд исследователей предложили гипотезу о повышении уровня транскрипции генов хромосомы Х у обоих полов для поддержания баланса с аутосомными генами в процессе эволюции до появления Х-инактивации у млекопитающих [Ohno, 1967]. Некоторыми авторами [Nguyen, Disteche, 2006] определялось соотношение уровней транскрипции Х-сцепленных и аутосомных генов в клетках некоторых тканей человека. Было показано, что это соотношение близко к 1:1, что означает повышение уровня транскрипции Х-сцепленных генов. Однако механизмы последнего еще предстоит открыть. Мутации Х-сцепленных генов (рецессивные и доминантные) у мужчин, имеющих единственную хромосому Х, проявляются в виде различных заболеваний довольно часто в тяжелой форме. У женщин-гетерозигот, благодаря наличию двух Х-сцепленных аллелей, заболевания, сцепленные с хромосомой Х, протекают в относительно более легкой форме по сравнению с мужчинами [Migeon, 2007]. Наличие одной активной хромосомы Х в каждой диплоидной клетке вне зависимости от того, сколько хромосом Х в ней присутствует, влияет на тяжесть клинических проявлений при анеуплоидиях по хромосоме Х. При наличии дополнительной хромосомы Х в кариотипе, клинические проявления у индивидуумов значительно более легкие, чем при известных трисомиях по аутосомам 13, 18 и 21. Кроме того, моносомия Х во многих случаях совместима с жизнью, а моносомии по аутосомам, в основном, летальны [Ворсанова и др., 2006]. Таким образом, с помощью механизма Х-инактивации может снижаться негативный эффект дополнительной дозы большинства генов хромосомы Х при синдромах Клайнфельтера и трисомии Х, а при синдроме Шерешевского-Тернера единственной хромосомы Х в кариотипе может быть достаточно для выживания индивидуума.
Однако хромосома Х в норме инактивируется не полностью, поскольку гены ее псевдоаутосомных регионов (PAR1 и PAR2) активны на инактивированной хромосоме Х у женщин, так же как на хромосоме Y у мужчин. Принято считать, что клинические симптомы, наблюдающиеся при анеуплоидиях по хромосоме Х, являются результатом аномальной дозы псевдоаутосомных генов, количество которых при синдромах трисомии Х и Клайнфельтера избыточно, а при синдроме Шерешевского-Тернера – уменьшено [Blaschke, Rappold, 2006; Yurov et al., 2007 а; 2014]. В организме женщины существуют две популяции клеток, в одной из которых активна хромосома Х, полученная ею от матери, а в другой – хромосома Х отцовского происхождения. В каждой клетке экспрессируются гены активной хромосомы Х, и мутация в гене на активной хромосоме Х будет иметь такой же «вредный» эффект у женщины, как и у мужчины с единственной хромосомой Х. У девочек-гетерозигот по Х-сцепленным мутациям имеются две популяции клеток (с активной хромосомой Х, несущей нормальный или мутантный аллель) [Migeon, 2008].
Несмотря на то, что клеточные популяции с активными хромосомами Х отцовского и материнского происхождения являются дискретными, существует множество путей, с помощью которых клетки из одной популяции могут взаимодействовать с другой, что особенно ярко проявляется в случаях женщин-гетерозигот по Х-сцепленным мутациям. Самое частое взаимодействие между двумя клеточными популяциями с активными хромосомами Х отцовского и материнского происхождения – так называемая конкуренция клеток, когда одна популяция «пытается перерасти» другую. Х-сцепленные мутации негативно влияют на пролиферацию клеток с мутацией на активной хромосоме Х, и эти клетки, в конце концов, элиминируются. В результате возникает, так называемый, сдвиг Х-инактивации вследствие селекции клеток против тех, в которых активна хромосома Х, несущая мутацию. Случаи сдвига Х-инактивации – это те случаи, где соотношение двух клеточных популяций значимо отклоняется от ожидаемого соотношения 1:1. Выявление сдвига Х-инактивации является мощным средством обнаружения Х-сцепленных мутаций, которые нарушают пролиферацию клеток [Migeon, 2007]. Среди ярких примеров иллюстрации конкуренции между двумя популяциями клеток можно выделить синдром недержания пигмента (Incontinentia pigmenti, IP), который является Х-сцепленной болезнью, связанной с мутациями гена IKBKG, кодирующего белок-модулятор нуклеарного фактора kappaB, дефицит которого ведет к усилению апоптоза. Клетки с мутациями гена IKBKG на активной хромосоме Х подвергаются апоптозу, что объясняет эмбриональную летальность мальчиков с IP-мутациями. У девочек-гетерозигот возникает сдвиг Х-инактивации вследствие гибели клеток с мутацией гена IKBKG на активной хромосоме Х. Гибель клеток кожи с мутантным аллелем на активной хромосоме Х наблюдается у больных девочек сразу после рождения [Ardelean, Pope, 2006], что наблюдается в виде стадийных поражений кожных покровов. Пример синдрома Блоха-Сульцбергера иллюстрирует то, как клинические симптомы могут проявляться в легкой форме, когда «мутантные» клетки элиминируются и замещаются
нормальными.
Клеточная селекция наблюдается при многих Х-сцепленных болезнях и обычно является однонаправленной по отношению к нормальному аллелю. Однако в редких случаях клетки с активным мутантным аллелем имеют пролиферативные преимущества. Таким исключением является адренолейкодистрофия (ALD) – сфинголипидоз, характеризующийся сочетанием лейкодистрофии и недостаточности функции коры надпочечников, обусловленным энзиматическим дефектом обмена жирных кислот. Гетерозиготы по ALD (мутации гена ABCD) имеют сдвиг Х-инактивации из-за клеточной селекции, способствующей экспрессии мутантного аллеля, что видно на рис. 27.
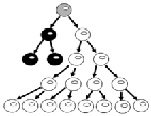
А. Клетки с нормальным аллелем на активной хромосоме Х (на рисунке белого цвета) имеют преимущество в пролиферации при таких Х-сцепленных синдромах, как Блоха-Сульцбергера, Айкарди, Барта, Лоу, FG, ото-палато-дигитальном и других
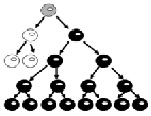
Б. Клетки с мутантным аллелем на активной хромосоме Х (на рисунке черного цвета) имеют преимущество в пролиферации при адренолейкодистрофии
Рис. 27. Формирование сдвига Х-инактивации в результате селекции клеток при различных формах Х-сцепленной умственной отсталости
Причины селективного преимущества клеток мутантного типа при ALD еще не поняты, но они объясняют появление патологических симптомов с возрастом у многих гетерозигот по данному заболеванию [Migeon, 2007]. Другой вид взаимодействия клеточных популяций у гетерозигот по Х-сцепленным мутациям – метаболическая кооперация. В клетках с мутантным аллелем на активной хромосоме Х не образуется белковый продукт данного гена, но его недостаток может быть компенсирован путем эффективной передачи этим клеткам необходимого генного продукта из клеток с нормальным аллелем на активной хромосоме Х. Взаимодействия, позволяющие клеткам обмениваться материалами, являются средством, используемым многоклеточными организмами для поддержания гомеостаза. Иногда межклеточная коммуникация требует тесного физического контакта – клетки должны соприкасаться друг с другом, чтобы осуществлять передачу продуктов через клеточные контакты. В других случаях секретированные клеточные продукты переносятся посредством таких внеклеточных жидкостей, как кровь, и захватываются клетками путем эндоцитоза. Метаболическая кооперация «маскирует» генотип. Поэтому женщины-гетерозиготы по той же мутации, которая является «вредоносной» и даже летальной для их сыновей, часто не имеют симптомов болезни. Примерами этого являются лизосомные болезни, в частности, синдром Хантера и болезнь Фабри. Лизосомные ферменты имеют остаток маннозо-6-фосфата, который распознается специфичными для него рецепторами, расположенными в мембранах клеток. Благодаря этому лизосомные гидролазы селективно связываются с мембранами, свободно проникают в лизосомы и покидают их, а также могут быть перенесены из одной клетки в другую путем маннозо-6-фосфат-опосредованного эндоцитоза. При синдроме Хантера матери и сестры пораженных мальчиков обычно не имеют проявлений болезни, поскольку клетки, которые синтезируют фермент идуронатсульфатазу, могут эффективно передавать его тем клеткам, которые его не синтезируют, как показано на рис. 28. Поскольку здесь нет основы для конкуренции клеток, то Х-инактивация является случайной и, чаще всего, сбалансированной. Факт метаболической кооперации клеток был использован для лечения мальчиков с синдромом Хантера путем трансфузии им донорских гематопоэтических стволовых клеток или рекомбинантного фермента [Pinto et al., 2010].
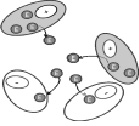
Рис. 28. Перенос лизосомных ферментов из нормальных в «мутантные» клетки при Х-сцепленых лизосомных болезнях. Клетки с нормальным аллелем на активной хромосоме Х (цитоплазма серого цвета со знаком «+» в ядрах) передают фермент (E) клеткам с мутантным аллелем на активной хромосоме Х (цитоплазма белого
цвета со знаком «-» в ядрах)
При болезни Фабри фермент альфа-галактозидаза передается от нормальной клетки к «мутантной» относительно малоэффективно по сравнению с идуронатсульфатазой при болезни Хантера. Как следствие дефицита альфа-галактозидазы у женщин-гетерозигот по болезни Фабри, проявляются некоторые клинические симптомы. Так, 90 % гетерозигот по данному заболеванию имеют легкое помутнение роговицы, хотя клинические проявления у них намного легче, чем у мужчин. Разница в уровне передачи лизосомных ферментов зависит от плотности маннозо-6-фосфат рецепторов клеточных мембран или расположения маннозо-6-фосфата в молекуле лизосомного фермента. На основании наблюдений за малоэффективной передачей альфа-галактозидазы у гетерозигот по болезни Фабри для лечения данной патологии стали использовать вместо натурального эффективно усваивающиеся синтетические формы фермента [Migeon, 2007].
При синдроме Леша-Нихана наблюдаются оба вида взаимодействий между клетками: конкурентное взаимодействие и метаболическая кооперация, но в разных тканях женщин-носительниц. При этом заболевании у гемизигот наблюдают тяжелый дефицит фермента гипоксантин фосфорибозил трансферазы (HPRT), что вызывает нарушение интеллекта, спастический церебральный паралич, отложения депозитов мочевой кислоты в суставах (подагру) и самодеструктивное поведение в виде кусания пальцев и губ. Женщины-носительницы, имеющие дефицитные и нормальные клетки, не проявляют никаких симптомов. В большинстве клеток тканей женщин-носительниц выявляется инозиновая кислота – продукт метаболической реакции, катализируемой HPRT, который переносится от нормальных клеток, где он образуется, к «мутантным» клеткам через межклеточные каналы. Эти каналы связывают цитоплазму соседних клеток и легко переносят молекулы через клеточные мембраны. Таким образом, нормальные клетки обеспечивают инозиновой кислотой клетки мутантного типа. Это пример метаболической кооперации. Однако, подобная ситуация отличается от других тканей. Клетки крови, например, не могут создавать межклеточные контакты и передавать инозиновую кислоту. Нормальный фермент HPRT обеспечивает клеткам крови с нормальным аллелем на активной хромосоме Х пролиферативные преимущества, и это ведет к постепенной элиминации HPRT-дефицитных клеток. У девочек-гетерозигот фермент-дефицитные клетки крови (лейкоциты и эритроциты) элиминируются к 10-летнему возрасту. Таким образом, особенности взаимодействий между клеточными популяциями могут приводить к различиям по характеру Х-инактивации между тканями одного и того же индивидуума [Migeon, 2008].
Существует еще один возможный вид взаимодействия между популяциями клеток, различающихся по активной хромосоме Х – интерференция клеток, когда мутантные продукты из аномальной клетки нарушают функцию нормальных клеток. Понимание этого вида клеточного взамодействия вытекает из исследований краниофронтоназального синдрома (CFNS), который проявляется преждевременным срастанием коронарного шва, отделяющего лобные и теменные кости. CFNS вызывается дефицитом кодируемого хромосомой Х белка из семейства эфринов – эфрина В1. Эфрин В1 является сигнальной молекулой для прекращения миграции клеток, формирующих кости черепа, «отражая» их от места расположения будущего коронарного шва. CFNS мутации приводят к более тяжелым дефектам у женщин-гетерозигот, чем у мужчин-гемизигот. Мужчины с дефицитом эфрина В1 имеют минимальные аномалии в отличие от женщин-носительниц, у которых наблюдается полный краниосиностоз и другие скелетные аномалии. Длительное время оставалось неясным, почему при данном заболевании краниосиностоз возникает только у женщин. Позднее было показано, что Х-инактивация у пораженных женщин является случайной. Превалирует мнение о том, что краниосиностоз возникает из-за присутствия у них смешанной популяции эфрин В1 – позитивных и негативных вместо гомогенной популяции клеток, что нарушает процесс формирования будущего коронарного шва, и ведет, в свою очередь, к преждевременному срастанию костей черепа. Чтобы объяснить, почему мужчины с мутацией минимально поражены, предполагают, что другие белки из семейства эфринов заменяют эфрин В1 в клетках мужчин. Известно всего несколько примеров такого взаимодействия, когда интерференция клеток у женщин-гетерозигот вызывает проблемы, не встречающиеся у мужчин-гемизигот [Twigg et al., 2004]. Таким образом, у носительниц Х-сцепленных мутаций клинические проявления зависят от характера взаимодействия между клетками с нормальным и мутантным аллелем на активной хромосоме Х.
Определение у гетерозигот соотношения числа клеток с мутантным и нормальным аллелем на активной хромосоме Х осуществляется преимущественно молекулярно-генетическими методами. Наиболее распространенным методом исследования особенностей Х-инактивации является метод, основанный на метилчувствительной рестрикции HpaII сайтов в интроне 1 гена андрогенного рецептора (AR) с последующей количественной ПЦР. Исследование данного гена используется потому, что он высокополиморфен, один его аллель отличается от другого по количеству повторов цитозин-аденин-гуанин в интроне 1 у большинства женщин (90 %). Метод основан также на использовании такой особенности неактивной хромосомы Х как метилирование цитозина CpG динуклеотидов в 5’-положении. Соотношение двух мозаичных клеточных популяций у гетерозигот определяется как соотношение родительских аллелей гена AR, которые метилированы (неактивны). О сдвиге Х-инактивации говорят в тех случаях, когда в 80 % и более клеток обнаруживается инактивация одной и той же хромосомы Х. Однако, следует иметь в виду, что даже соотношение родительских аллелей 80:20 может быть внутри нормального распределения, особенно когда учитываются стохастические девиации в биологических процессах, поскольку сдвиг может возникнуть даже тогда, когда Х-инактивация прошла случайно вследствие ограниченного количества клеток-предшественников, присутствующих в эмбрионе в момент формирования активной хромосомы Х. Поэтому неравная Х-инактивация встречается среди фенотипически нормальных женщин, согласно данным литературы, с частотой от 3 до 17 % [Юров и др., 2004 а].
Как правило, при Х-сцепленных болезнях образование активной хромосомы Х вначале носит случайный характер, а неравная Х-инактивация является результатом различий пролиферации клеток с нормальным и мутантным аллелем на активной хромосоме Х. Следовательно, сдвиг Х-инактивации вторичен по отношению к селекции клеток. Однако сдвиг Х-инактивации может возникать первично во время процесса выбора активной хромосомы Х в эмбриогенезе. Это может быть связано с мутацией в гене XIST, что приводит к неслучайному выбору активной хромосомы Х, и хромосома, на которой расположен мутантный аллель XIST, всегда активна [Puck, Willard, 1998]. В литературе приводятся наблюдения, когда мутации в промоторе гена XIST у девяти женщин из двух неродственных семей приводили к полному сдвигу Х-инактивации [Plenge et al., 1997]. Описана также семья, в которой гемофилия А наблюдалась у трех женщин, что связывалось с неслучайным выбором активной хромосомы Х [Bicocchi et al., 2005]. Вероятно, что мутация гена XIST на активной хромосоме Х каждой пораженной женщины в этих случаях нарушала инактивацию хромосомы Х.
Таким образом, сдвиг Х-инактивации, как правило, отражает процесс селекции клеток с активными мутантным и нормальным аллелями на активной хромосоме Х в женском организме, но в редких случаях может возникать первично вследствие мутаций гена XIST.
