
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ЛЕЧЕНИЕ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩИХ РАН МЕТОДОМ ОЗОНОТЕРАПИИ И НИЗКОЧАСТОТНЫМ УЛЬТРАЗВУКОМ
Микитин И. Л., Карапетян Г. Э., Винник Ю. С., Якимов С. В., Кириченко А. К.,
Глава 2. МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
С целью обоснования эффективности лечения длительно незаживающих ран венозной этиологии методом, включающим в себя сочетание озонотерапии и ультразвука, был проведен эксперимент на 30 кроликах породы «Шиншилла» 6-месячного возраста обоего пола с массой тела 2,5–3,5 килограмма.
Все экспериментальные животные были разделены на 6 равных групп по 5 кроликов в каждой. В первой группе на протяжении всего эксперимента кролики оставались интактными. Во второй группе осуществлялось моделирование гнойно-некротической раны, лечение не проводилось. В третьей группе после моделирования гнойной раны, начиная с 4-х суток, дважды в сутки осуществлялось лечение, включающее в себя в первую фазу раневого процесса обработку раны хлоргексидином, а после образования грануляций – мазью «Актовегин». В четвертой группе лечение ран проводилось озонированной дистиллированной водой и озонированным оливковым маслом «Отри». Пятая группа состояла из 5 кроликов, получавших после моделирования гнойной раны лечение хлоргексидином и «Актовегином» в сочетании с ультразвуком. В шестой группе экспериментальных кроликов лечение гнойной раны проводили озонированной дистиллированной водой и озонированным оливковым маслом «Отри» в сочетании с ультразвуком. При гистологическом исследовании раны к 4-м суткам после моделирования во всех группах экспериментальных животных отмечалась однотипная картина: пролиферативные изменения в эпидермисе, обусловленные агрессивным воздействием патогенной микрофлоры. На фоне выраженного отека дермы происходила инфильтрация ткани лейкоцитами, отек определялся и в эндотелии мелких сосудов (рис. 2.1).
Лимфоциты, макрофаги и фибробласты были представлены в значительно меньшем количестве. Фибриновые волокна определялись в небольшом количестве с явлениями набухания и расплавления (рис. 2.2).
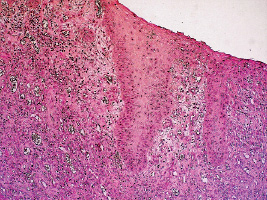
Рис. 2.1. Биоптат из края раны экспериментального животного 2-й серии
на 4-е сутки после моделирования. Пролиферативные изменения
в эпидермисе. Инфильтрация ткани лейкоцитами.
Окраска гематоксилином и эозином. Ув. Х200
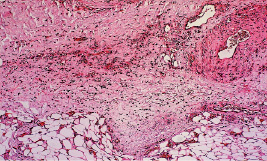
Рис. 2.2. Биоптат из края раны экспериментального животного 2-й серии
на 4-е сутки после моделирования. Лейкоцитарная инфильтрация,
отек дермы. Окраска гематоксилином и эозином. Ув. х100
Микробиологическое исследование раны выявило большое количество кокков, расположенных в основном внеклеточно, что, вероятно, объясняется слабой выраженностью фагоцитоза (табл. 2.1).
Таблица 2.1
Содержание клеточных элементов (в %) и кровеносных сосудов (количество на 1 кв. мм) в соединительной ткани из края раны
на 4-е сутки после моделирования
|
2 группа |
3 группа |
4 группа |
5 группа |
6 группа |
р |
|
|
Нейтрофилы |
59,93 ± 3,14 |
60,89 ± 2,35 |
60,15 ± 3,01 |
60,07 ± 2,76 |
60,1 ± 2,85 |
р* = 0,524 |
|
Лимфоциты |
8,63 ± 1,24 |
9,01 ± 1,47 |
8,12 ± 1,47 |
8,91 ± 1,09 |
8,52 ± 1,39 |
р* = 0,699 |
|
Макрофаги |
8,27 ± 1,19 |
8,04 ± 1,23 |
8,32 ± 1,16 |
8,17 ± 1,04 |
8,29 ± 1,15 |
р* = 0,235 |
|
Фибробласты |
23,17 ± 1,95 |
22,06 ± 2,31 |
23,41 ± 2,14 |
22,85 ± 2,07 |
23,09 ± 1,95 |
р* = 0,412 |
|
Кровеносные сосуды |
55,18 ± 15,98 |
Примечания:
р* – значимость различий между несколькими группами по Н-критерию Краскела – Уоллиса (Kruskal – Wallis test);
р** – значимость различий между несколькими группами методом дисперсионного анализа (ANOVA).
К 9-м суткам после моделирования и 5-м суткам после начала лечения отмечались существенные различия при гистологическом и морфометрическом исследовании биоптатов из краев ран.
В контрольной группе в ране определялся выраженный отек. По прежнему на высоком уровне оставалось количество нейтрофильных гранулоцитов, увеличивалось количество капилляров на единицу площади дермы (рис. 2.3).
Несмотря на некоторое снижение полиморфно-клеточной воспалительной инфильтрации, достоверных отличий по сравению с 4-ми сутками после моделирования в контрольной группе выявлено не было.
В 3-й серии, где в течение 5 дней проводилось лечение хлоргексидином и актовегином, отек был выражен в меньшей степени. При исследовании качественного состава клеточных элементов наблюдалось увеличение процентного соотношения в пользу фибробластов и макрофагов. Возрастало количество сосудов на единицу площади дермы.
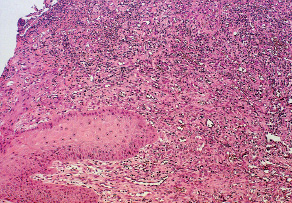
Рис. 2.3. Биоптат из края раны экспериментального животного
2-й серии на 9-е сутки после моделирования.
Отек, очаги деструкции, выраженная лейкоцитарная инфильтрация дермы. Окраска гематоксилин-эозин. Ув. Х200
В 4-й и 5-й группах при использовании в течение 5-ти суток озонированной дистиллированной воды с озонированным оливковым маслом «Отри» и хлоргексидина, актовегина и ультразвука, происходило снижение отека и. достоверно по сравнению с контрольной группой уменьшалось количество нейтрофилов, увеличивалось количество новообразованных сосудов. Отмечалась начало формирования грануляционной ткани (рис. 2.4).
В 6-й серии при лечении гнойной раны озонированной дистиллированной водой и озонированным оливковым маслом в сочетании с ультразвуком к 9-м суткам после моделирования отмечалось уменьшение отека тканевых структур. Снижалось общее количество лимфоцитов, нейтрофилов, макрофагов с преобладанием доли фибробластов и макрофагов, в большом количестве определялись сосуды, прорастающие ткань с формированием грануляционной ткани (рис. 2.5).
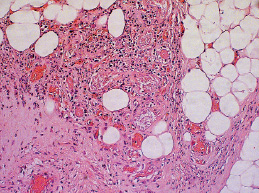
Рис. 2.4. Биоптат из края раны экспериментального животного 5-й группы на 9-е сутки после моделирования. Умеренная инфильтрация ткани лейкоцитами. Начало формирования грануляционной ткани Ув. Х200
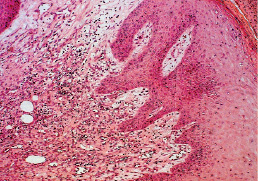
Рис. 2.5. Биоптат из края раны экспериментального животного 6-й серии на 9-е сутки после моделирования. Умеренная инфильтрация ткани лейкоцитами. Активная пролиферация сосудов капиллярного типа. Ув. Х200
К 9-м суткам послеоперационного периода в гистологических препаратах отмечалось уменьшение отека, снижение количества лейкоцитов и увеличение инфильтрации ткани макрофагами и фибробластами. Во второй серии кроликов, не получавших лечения, эти изменения были выражены в меньшей степени. В ткани определялся отек, клеточная воспалительная инфильтрация с преобладанием нейтрофилов. В количественном отношении число нейтрофилов в ране снизилось по сравнению с 4-ми сутками на 9,4 %, соответственно увеличилось число лимфоцитов и макрофагов, однако эти отличия не были достоверными. Прогрессирование воспалительного процесса снижалось за счет мобилизации защитных сил организма, ответа иммунной системы, но процессы очищения и заживления раны без лечения продвигались крайне медленно. В 3-й, 4-й и 5-й группах к 9-м суткам после моделирования значительных отличий в течении раневого процесса не отмечалось.
Количество нейтрофилов прогрессивно снижалось, увеличивалось процентное соотношение в пользу лимфоцитов, макрофагов и фибробластов (рис. 2.6). В ранах у животных этих серий заметно увеличивалось количество кровеносных сосудов.
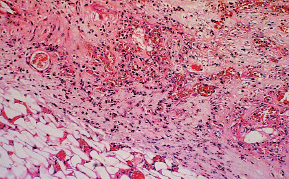
Рис. 2.6. Биоптат из края раны экспериментального животного 4-й серии
на 9-е сутки после моделирования. Лейкоцитарная инфильтрация дермы, отек ткани. Окраска гематоксилин-эозин. Ув. Х200
Более благоприятное течение раневого процесса отмечалась в 6-й серии. Количество нейтрофилов в биоптате из раны к 9-м суткам послеоперационного периода снизилось на 44,7 %.
Статистически значимо увеличилось количество макрофагов, фибробластов и кровеносных сосудов (табл. 2.2, 2.3, рис. 2.7).
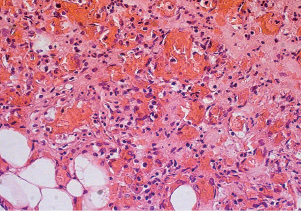
Рис. 2.7. Биоптат из края раны экспериментального животного 6-й серии
на 9-е сутки после моделирования. Нарастает круглоклеточная инфильтрация с примесью макрофагов, фибробластов, пролиферация эндотелия мелких сосудов. Окраска гематоксилин-эозин. Ув. Х400
К 12-м суткам эксперимента сохранялись наметившиеся тенденции заживления гнойных ран. Наиболее медленно протекали процессы регенерации в группе кроликов, не получавших лечения. Уровень нейтрофилов составлял 43,57 ± 2,63 % по отношению к другим клеточным элементам. Несколько увеличилось количество фибробластов, однако их было значительно меньше чем в других экспериментальныч сериях (рис. 2.8).
В 3-й, 4-й и 5-й сериях значительно уменьшалось количество нейтрофилов и возрастало процентное соотношение лимфоцитов, плазмоцитов и фибробластов (рис. 2.9).
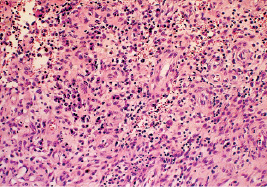
Рис. 2.8. Биоптат из края раны экспериментального животного 2-й серии на 12-е сутки после моделирования. Лейкоцитарная инфильтрация дермы сохраняется. Окраска гематоксилин-эозин. Ув. Х400
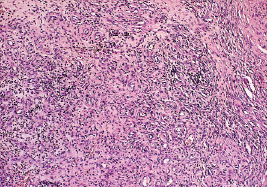
Рис. 2.9. Биоптат из края раны экспериментального животного 5-й серии на 12-е сутки после моделирования. Лейкоцитарная инфильтрация дермы незначительная. Окраска гематоксилин-эозин. Ув. х200
В большей степени эти изменения были выражены в 6-й группе, где для лечения применяли сочетание озонированной дистиллированной воды, озонированного оливкового масла и ультразвука (рис. 2.10, табл. 2.4, 2.5).
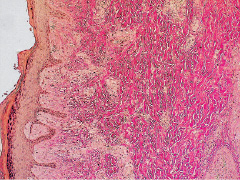
Рис. 2.10. Биоптат из края раны экспериментального животного
6-й серии на 12-е сутки после моделирования. Лейкоцитарная инфильтрация дермы минимальная. Преобладают фибропластическая трансформация дермы и новообразованные сосуды Окраска на коллагеновые волокна
по Ван-Гизону. Ув. х100
Для более объективной оценки полученных результатов был проведен сравнительный анализ гистологического исследования тканей у лабораторных животных контрольной группы, 3-й и 6-й группы. Следует отметить, что в большинстве наблюдений достоверных отличий между результатами лечения в 3-й, 4-й и 5-й группах выявить не удалось.
При сравнении процентного соотношения клеточных элементов и количества кровеносных сосудов на 1 квадратном миллиметре ткани вокруг раны у лабораторных животных к 12-м суткам послеоперационного периода, были получены следующие результаты: в контрольной группе сохранялся высокий уровень нейтрофилов, что можно интерпретировать, как подтверждение адекватности моделирования гнойной раны. При сравнении традиционного лечения и лечения с помощью озонотерапии и ультразвука количество нейтрофилов достоверно быстрее снижалось при применения озонотерапии и ультразвука (рис. 2.11).
Таблица 2.2
Содержание клеточных элементов (в%) у экспериментальных животных в соединительной ткани из края раны
на 9-е сутки после моделирования
|
2 группа |
3 группа |
4 группа |
5 группа |
6 группа |
Р |
|
|
9,22 ± 1,43 |
9,23 ± 2,37 |
8,17 ± 1,83 |
7,43 ± 1,67 |
|||
|
Макрофаги |
Примечание. р2-3 – значимость различий между 2 и 3 группой, р2-4 – значимость различий между 2 и 4 группой, р2-5 – значимость различий между 2 и 5 группой, р2-6 – значимость различий между 2 и 6 группой, р3-4 – значимость различий между 3 и 4 группой, р3-5 – значимость различий между 3 и 5 группой, р3-6 – значимость различий между 3 и 6 группой, р4-5 – значимость различий между 4 и 5 группой, р4-6 – значимость различий между 4 и 6 группой, р5-6 – значимость различий между 5 и 6 группой.
Таблица 2.3
Содержание клеточных элементов (в %) и кровеносных сосудов (количество на 1 кв. мм) у экспериментальных животных в соединительной ткани из края раны
на 9-е сутки после моделирования
|
2 группа |
3 группа |
4 группа |
5 группа |
6 группа |
Р |
|
|
Фибробласты |
25,71 ± 2,28 |
32,03 ± 1,83 |
33,12 ± 2,16 |
34,28 ± 1,39 |
40,05 ± 2,03 |
|
|
Кровеносные сосуды |
Примечание. р2-3 – значимость различий между 2 и 3 группой, р2-4 – значимость различий между 2 и 4 группой, р2-5 – значимость различий между 2 и 5 группой, р2-6 – значимость различий между 2 и 6 группой, р3-4 – значимость различий между 3 и 4 группой, р3-5 – значимость различий между 3 и 5 группой, р3-6 – значимость различий между 3 и 6 группой, р4-5 – значимость различий между 4 и 5 группой, р4-6 – значимость различий между 4 и 6 группой, р5-6 – значимость различий между 5 и 6 группой.
Уровень содержания лимфоцитов в биоптатах из ран у лабораторных животных к 12 суткам после моделирования существенно не различался. В 6-й группе количество лимфоцитов было несколько ниже, вероятно, за счет уменьшения воспалительной реакции и активации процессов регенерации тканей (рис. 2.12).
Таблица 2.4
Содержание клеточных элементов (в %) в соединительной ткани из края раны на 12-е сутки после моделирования у экспериментальных животных
|
2 группа |
3 группа |
4 группа |
5 группа |
6 группа |
Р |
|
|
Нейтрофилы |
р2-3 < 0,001 р2-4 < 0,001 р2-5 < 0,001 р2-6 < 0,001 |
|||||
|
Лимфоциты |
6,18 ± 2,31 |
6,11 ± 1,98 |
7,02 ± 1,71 |
8,13 ± 1,18 |
6,04 ± 1,23 |
р2-3 < 0,001 р2-4 < 0,001 р2-5 < 0,001 р2-6 < 0,001 р3-4 = 0,752 р3-5 < 0,001 р3-6 < 0,001 р4-5 < 0,001 р4-6 < 0,001 р5-6 < 0,001 |
|
Макрофаги |
7,85 ± 1,39 |
р2-3 < 0,001 р2-4 < 0,001 р2-5 < 0,001 р2-6 < 0,001 р3-4 = 0,381 р3-5 = 0,498 р3-6 < 0,001 р4-5 = 0,661 р4-6 < 0,001 р5-6 < 0,001 |
Примечание. р2-3 – значимость различий между 2 и 3 группой, р2-4 – значимость различий между 2 и 4 группой, р2-5 – значимость различий между 2 и 5 группой, р2-6 – значимость различий между 2 и 6 группой, р3-4 – значимость различий между 3 и 4 группой, р3-5 – значимость различий между 3 и 5 группой, р3-6 – значимость различий между 3 и 6 группой, р4-5 – значимость различий между 4 и 5 группой, р4-6 – значимость различий между 4 и 6 группой, р5-6 – значимость различий
между 5 и 6 группой.
Таблица 2.5
Содержание клеточных элементов (в %) и кровеносных сосудов (количество на 1 кв. мм) в соединительной ткани из края раны
на 12-е сутки после моделирования у экспериментальных животных
|
2 группа |
3 группа |
4 группа |
5 группа |
6 группа |
Р |
|
|
Фибробласты |
35,17 ± 1,26 |
41,25 ± 2,18 |
42,36 ± 2,43 |
42,91 ± 2,63 |
71,17 ± 2,14 |
|
|
Кровеносные сосуды |
98,31 ± 15,21 |
Примечание. р2-3 – значимость различий между 2 и 3 группой, р2-4 – значимость различий между 2 и 4 группой, р2-5 – значимость различий между 2 и 5 группой, р2-6 – значимость различий между 2 и 6 группой, р3-4 – значимость различий между 3 и 4 группой, р3-5 – значимость различий между 3 и 5 группой, р3-6 – значимость различий между 3 и 6 группой, р4-5 – значимость различий между 4 и 5 группой, р4-6 – значимость различий между 4 и 6 группой, р5-6 – значимость различий между 5 и 6 группой.
К 12-м суткам эксперимента достоверно изменялось количество макрофагов в различных группах. Наиболее значительным их содержание было во второй группе, что объясняется активностью воспалительного процесса. Высокое процентное содержание макрофагов отмечалось при лечении хлоргексидином и актовегином. На фоне проводимого лечения стимулировался тканевой иммунитет, происходило очищение раневой поверхности от патогенных микроорганизмов. Значительное снижение процентного содержания макрофагов при сочетании озонотерапии и ультразвука явилось результатом перехода раневого процесса в фазу регенерации у животных 6-й группы (рис. 2.13).
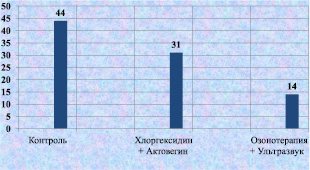
Рис. 2.11. Процентное содержание нейтрофилов в биоптате из края раны у лабораторных животных к 12-м суткам послеоперационного периода
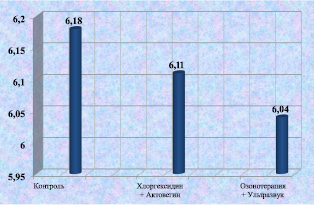
Рис. 2.12. Процентное содержание лимфоцитов в биоптате из края раны у лабораторных животных к 12-м суткам послеоперационного периода
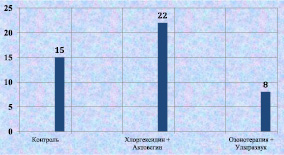
Рис. 2.13. Процентное содержание макрофагов в биоптате из края раны у лабораторных животных к 12-м суткам послеоперационного периода
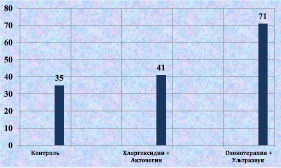
Рис. 2.14. Процентное содержание фибробластов в биоптате из края раны у лабораторных животных к 12-м суткам послеоперационного периода
К 12-м суткам после моделирования гнойной раны сочетанное применение озонотерапии и ультразвука способствовало статистически значимому увеличению количества фибробластов в ране (рис. 2.14). Активизация репаративных процессов проявлялась и в увеличении количества кровеносных сосудов в соединительной ткани вокруг раны (рис. 2.15).
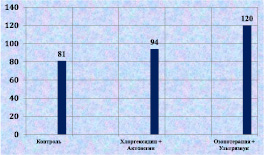
Рис. 2.15. Количество кровеносных сосудов в 1 кв. мм ткани биоптата
из края раны к 12-м суткам послеоперационного периода
В настоящее время в фундаментальной медицине ведется активный поиск методик, позволяющих объективно и в короткое время провести анализ различных биологических тканей, жидкостей, метаболитов. Одним из наиболее перспективных направлений является биолюминесцентный анализ.
Метод основан на трансформации энергии химических реакций в излучение оптического диапазона с помощью ферментов – люцифераз. При измерении параметров излучения определяют интегральную токсичность исследуемого вещества. Метод является высокочувствительным, позволяет измерять отдельные молекулярные события. Чувствительность при биолюминесцентном анализе для некоторых веществ (АТФ, НАДН) до 10–17–10–19 моль, т.е. всего 104–106 молекул. Лежащая в основе метода ферментативная реакция определяет его высокую специфичность. Энергетическое обеспечение биолюминесценции осуществляется через общие метаболические пути клетки, что позволяет строить цепи сопряжения ферментов с люциферазой таким образом, что концентрация большинства ключевых метаболитов может быть измерена через биолюминесценцию.
Биолюминесцентный метод был апробирован нами с целью определения суммарной метаболической активности биоптатов из раны к 4-м, 9-м и 12-м суткам после моделирования. Интегральная метаболическая активность измерялась в сопряженной системе: субстрат – биферментный комплекс NADH:FMN – оксидоредуктаза/люцифераза по скорости падения интенсивности биолюминесценции с использованием светящихся бактерий (Photobacterium phosphoreum), а также растворимых ферментов (рис. 2.16). В 3-й, 4-й и 5-й группах при исследовании биолюминесценции биоптатов из язвы не было выявлено статистически значимых отличий в течение всего эксперимента.
К 4-м суткам после моделирования гнойной раны показатели люциферазного индекса во всех группах находились на высоком уровне, что свидетельствовало о значительной интегральной токсичности биоптатов, обусловленной активной фазой гнойного воспаления в ране, высоким уровнем содержания метаболитов патогенных микроорганизмов.
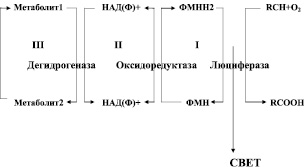
Рис. 2.16. Цепь сопряженных реакций
Через 9 дней после моделирования раны во второй группе кроликов, не получавших лечения, люциферазный индекс достигал 0,61 (у.е.), что соответствует высокому уровню интегральной токсичности. При лечении хлоргексидином и актовегином люциферазный индекс снижался до 0,53 (у.е.). Минимальное значение интегральной токсичности было в 3-й группе и составляло 0,42 (у.е.) (рис. 2.17). Данная тенденция сохранялась на протяжении всего эксперимента. В контрольной группе к 12-м суткам после моделирования уровень интегральной токсичности снизился с 0,64 до 0,57 (у.е.), в группе
животных, получавших в качестве лечения озонотерапию и ультразвук, к концу эксперимента было самое низкое значение люциферазного индекса – 0,2 (у.е.), что можно объяснить активизацией репаративных процессов, низким содержанием лейкоцитов и продуктов их жизнедеятельности в биоптате (рис. 2.18).
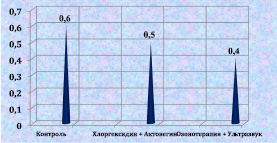
Рис. 2.17. Значение люциферазного индекса биоптата из раны животного
3-й серии в условных единицах к 9-м суткам послеоперационного периода
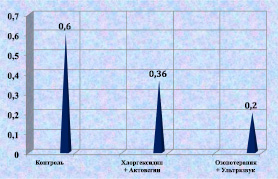
Рис. 2.18. Значение люциферазного индекса биоптата из раны животного
6-й серии в условных единицах к 12-м суткам послеоперационного периода
Одним из проявлений активности воспалительного процесса в модели гнойно-некротической раны у кроликов является уровень кровотока в окружающих рану тканях.
Таблица 2.5
Исследование микроциркуляции в гнойно-некротической ране у лабораторных животных (мл/мин на 100 грамм ткани)
|
Группы животных |
Сроки регистрации кровотока |
p |
||
|
4-е сутки |
9-е сутки |
12-е сутки |
||
|
2-я группа. Модель без лечения |
13,1 ± 1,95 |
р4-9 = 0,563 р4-12 = 0,542 р9-12 = 0,457 |
||
|
3-я группа. Хлоргексидин + Актовегин |
10,2 ± 1,23 |
8,4 ± 1,05* |
р4-9 = 0,265 р4-12 < 0,01 р9-12 = 0,337 |
|
|
4-я группа Озонотерапия |
9,7 ± 1,14 |
7,9 ± 1,83* |
р4-9 = 0,489 р4-12 < 0,01 р9-12 = 0,098 |
|
|
5-я группа. Хлоргексидин + Актовегин + Ультразвук |
11,9 ± 1,3 |
9,8 ± 1,83 |
8,6 ± 2,21* |
р4-9 = 0,253 р4-12 < 0,01 р9-12 = 0,320 |
|
6-я группа. Озонотерапия + Ультразвук |
8,3 ± 1,24* |
6,5 ± 1,2* |
р4-9 < 0,01 р4-12 < 0,01 р9-12 < 0,01 |
|
Примечание. * – означает достоверность различий по сравнению с 4-ми сутками после моделирования при р < 0,05.
Для оценки микроциркуляции использовали метод лазер-допплер флоуметрии. Измерение капиллярного кровотока производили непосредственно в ране на протяжении всего эксперимента. Использовали датчик типа S (Straight/прямой). Для регистрации показателей фиксировали информацию цифрового дисплея. Считывали информацию в течение 5 минут трижды и записывали наименьшее
значение в связи с тем, что все помехи увеличивают показания. Анализ полученных результатов выявил следующие закономерности: к 4-м суткам после моделирования во всех группах кроликов в ране отмечались высокие цифры кровотока, статистически значимых отличий в интенсивности кровотока между группами выявлено не было. Это подтверждает наличие активного воспалительного процесса в ране и адекватность модели во всех группах кроликов.
Во второй группе животных с моделью гнойно-некротической раны без лечения на протяжении всего эксперимента уровень кровотока в области раны оставался повышенным. В 3-й, 4-й и 5-й сериях эксперимента в динамике происходило снижение интенсивности кровотока, что свидельствовало о переходе активной фазы гнойного процесса в репаративную. В большей степени эта тенденция была выражена в 6-й группе, где для лечения использовали озонотерапию, и ультразвук (табл. 3.5).