
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Функциональные и метаболические эффекты симпато-адреналовой системы и стресс
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
4. Стресс и биоэнергетические процессы
Гибкость стрессорных реакций зависит от функциональной взаимосвязи различных звеньев нейроэндокринных регуляторных механизмов и биоэнергетических процессов. Энергия, превращение энергии в организме, относится к числу тех явлений, с которыми все живые системы и различные биологические процессы, в том числе и процессы успешной адапатации, неразрывно и постоянно связаны и зависимы.
Жизнь может существовать и развиваться только за счет поступления свободной энергии. Этот приток энергии обеспечивается непрерывным обменом веществ между организмом и окружающей средой. Все что мы видим, слышим и чувствуем, есть проявление какой-либо формы энергии, которая трансформируется в организме человека и других живых системах из поступающих извне разнообразных питательных веществ, энергия в которых представлена в форме химических связей между атомами органических молекул.
Трансформированная из химической формы, энергия метаболизирующихся органических соединений используется для осуществления всех функций клеток и органов, для обеспечения всех физиологических процессов организма, для обеспечения механизмов адаптации к стрессу.
Процессы, трансформирующие энергию в клетке, главным образом, сосредоточены в митохондриях. В митохондрииях быстро и очень экономно осуществляется процесс окисления различных субстратов путем отщепления атома водорода (протон и электрон). Тем самым обеспечивается трансформация химической энергии окисляемых субстратов вначале в разность редокс-потенциалов и электрохимический мембранный потенциал, возникающий за счет градиента концентрации протонов на мембране, затем на процесс окислительного фосфорилирования, завершающийся синтезом АТФ (P. Mitchel, 1961, 1967, 1974).
Способность митохондрий в процессе окисления субстратов составлять градиент концентрации протонов на внутренней мембране, как унифицированной форме трансформации энергии химической связи в энергию электрохимического мембранного потенциала (Mitchell P., 1961, В.П. Скулачев, 1972), приводит к изменению рН внутренней срезы, что открывает возможность для некоторых ферментов включаться в регуляцию энергетического обмена. Одним из таких ферментов является Н+-АТФ-аза.
В этом процессе также участвуют ферменты, осуществляющие дегидрогеназную реакцию и перенос протонов и электронов на конечный акцептор – кислород. Все эти ферменты структурно организованы в дыхательную митохондриальную цепь:
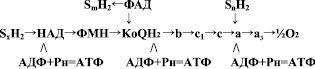
В начале дыхательной цепи митохондрий находятся анаэробные дегидрогеназы, коферментом которых является НАД или НАДФ. К этой группе относятся дегидрогеназы окисляющие пируват, изоцитрат, альфа-кетоглутарат, малат, глутамат, b-гидроксиацил-КоА и некоторые другие субстраты (SхH2). Далее располагаются НАДН-дегидрогеназа, относящаяся к флавиновым аэробным дегидрогеназам, кофермент которых ФМН. Здесь же к дыхательной цепи примыкают другие флавиновые дегидрогеназы с коферментом ФАД (сукцинатдегидрогеназа, глицерофосфатдегидрогеназа, ацил-КоА-дегидрогеназа), окисляющие соответствующие субстраты (SmH2).
Всеобщим коллектором атомов водорода в дыхательной цепи является убихинон (КоQ). Далее дыхательная цепь представлена ферментами цитохромной системы: цитохром b, c1, c, a, a3. На уровне цитохрома С также возможно окисление субстратов (SnH2), например адреналин и аскорбат.
Перемещение электронов и протонов происходит по градиенту окислительно-восстановительного (редокс) потенциала, который отражает величину свободной энергии окисления в соответствующей редокс-системе. Величина редокс-потенциала компонентов дыхательной цепи возрастает от НАД (–0,32 в) до кислорода (+0,82 в). Общая разность редокс-потенциалов в дыхательной цепи составляет 1,14 в. Такое количество свободной энергии, высвобождающейся при переносе двух электронов от НАД Н2 на кислород достаточно для синтеза трех молекул АТФ.
Синтез АТФ осуществляется на уровне трех участков дыхательной цепи митохондрий, где имеется достаточной величины разность редокс-потенциалов. Первый участок находится между НАД и ФМН, где разность редокс-потенциалов равна 0,21 в, второй – между цитохромом b и с, разность 0,22 в и третий между цитохромоксидазой (а + а3) и кислородом, разность редокс-потенциалов равна 0,29 в.
При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одного до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ.
Зависимость скорости дыхания от фосфорилирования может быть нарушена различными физическими и химическими агентами. При этом транспорт электронов и поглощение кислорода митохондриями протекает независимо от фосфорилирования. Это явление получило название разобщения окислительного фосфорилирования.
Разобщение окислительного фосфорилирования имеет место и при некоторых постстрессорных функциональных состояниях оргнизма: при охлаждении голодании при переутомлении при травматическом шоке, инфаркте миокарда при тиреотоксикозе, опухолях, при рентгеновском облучении и радиационном поражении (К.П. Хансон, 1965, В.С. Петров и др., 1966).
Особое место в дыхательной цепи занимает сукцинатдегидрогеназа (СДГ), субстрат которой, янтарная кислота, способен «монополизировать» дыхательную цепь, обращать движение электронов на первом участке сопряжения дыхания и фосфорилирования.
На внутренней мембране митохондрий имеется фермент моноаминоксидаза (МАО), дезаминирующий биогенные амины с образованием аммонийного иона, который согласно многочисленным исследованиям способен, изменняя рН, включаться в регуляцию окислительного фосфорилирования, вызывая разобщение, блокировать цикл трикарбоновых кислот на уровне окисления альфа-кетоглутарата. Аммонийный ион снижает активность цитохромоксидазы, окисление сукцината, пирувата, лактата и АТФ-азы.
Источником аммиака в тканях момогут быть аденин, аденозин, АМФ, АДФ, НАД, а также амидные группы белков (Г.Х. Бунатян и др., 1967). Особое место в превращении адениловых нуклеотидов и аденозина занимают дезаминазы, которые способны не только приводить к образованию аммиака, но и выключать АМФ, АДФ и даже АТФ из системы регуляции дыхания и фосфорилирования.
Таким образом, энергетический обмен представляет собой сложный механизм катаболитических процессов, локализованных главным образом в митохондриях всех клеток, работающих как термодинамическая машина, извлекающая свободную энергию химически связей в процессе окисления субстратов и трансформирующих ее в электрохимический мембранный потенциал и затем в энергию химических связей макроэргических соединений.
В тоже время конкретное участие вышеперечисленных систем, характер их взаимоотношений в процессе формирования эмоционально-стрессорного состояния, прогностическое значение отдельных показателей и их комплексов остаются недостаточно изученными. В этом отношении недостаточно изучены нарушения биоэнергетических процессов при стрессе, обеспечивающих все уровни адаптационных механизмов.
Предположительно, что при действии на организм чрезвычайных раздражителей естественным образом происходит перестройка биоэнергетики клетки. В связи с высокой дифференцировкой клеток различных тканей и органов, отношение последних к энергетическим трансформациям неодинаково. Но вместе с тем, при стрессовых состояниях имеет место одинаковая направленность изменений энергетического обмена. Например, при травматическом шоке, при гипотермии, радиации, имеет место изменение функций митохондрий, разобщение окислительного фосфорилирования. Установлено, что неспецифические стрессовые нагрузки выводят энергетический обмен на границу физиологического уровня, переводя его в низкоэнергезированное состояние.
Показано, что одной из наиболее стойкой к повреждению является система окисления янтарной кислоты (сукцинатдгидрогеназа), которая, например, при инфаркте миокарда повреждается в меньшей степени и восстанавливается более полно, чем система НАД-зависимых дегидрогеназ (Т.В. Фетисова, Р.А. Фролькис., 1976). Авторы считают, что окисление янтарной кислоты становится основным энергодающим процессом, восполняющим ущерб запасов макроэргов при стрессорных поражениях миокарда.
Как было показано нашими исследованиями (С.О. Тапбергенов, 1987), при нейрогенном стрессе, вызванным трехчасовой электростимуляцией дуги аорты в митохондриях сердца почти вдвое возрастает активность сукцинатдегидрогеназы, фермента монополизирующего дыхательную цепь (табл. 7). При нейрогенном стрессе активируется терминальный фермент дыхательной цепи цитохром-с-оксидаза и фермент, ответственный за синтез и распад АТФ – Mg-активируемая АТФ-аза. Возростает активность АМФ-дезаминазы, контролирующий уровень АМФ и аденозина, увеличивается активность моноаминоксидазы А и В-типа (табл. 7).
Таблица 7
Активность ферментов митохондрий сердца при нейрогенном стрессе, вызванным электростимуляцией дуги аорты
|
Фермент |
Контроль |
Нейрогенный стресс |
|
|
Сукцинатдегирогеназа |
29,04 ± 1,84 |
54,61 ± 5,60* |
|
|
Цитохром-с-оксидаза |
17,78 ± 2,20 |
31,72 ± 1,85* |
|
|
Mg активируемая-АТФ-аза |
46,29 ± 1,84 |
59,70 ± 4,51* |
|
|
АМФ-дезаминаза |
73,20 ± 5,52 |
148,73 ± 15,25* |
|
|
МАО |
А-тип |
43,03 ± 7,91 |
62,18 ± 5,91* |
|
Б-тип |
100,28 ± 13,33 |
222,46 ± 11,12* |
|
Примечание: * – p < 0,01 по сравнении с контролем.
Все эти данные отражают в какой-то степени состояние адаптационных механизмов при нейрогенном стрессе. На фоне изменённой функции симпато-адреналовой системы происходят изменения, направленные на сохранение энергообеспечения в самом чувствительном к нейрогенному стрессу органу – сердце, на устранение чрезмерной адренергической импульсации через повышение активности МАО в сердце.
Как было показано, метаболиты МАО могут ингибировать некоторые дыхательные ферменты, в частности сукцинатдегидрогеназу (В.З. Горкин и др., 1971), активировать глюкозо-6-фосфатдегидрогеназу и транскетолазы и ускоряют окисление глюкозы по апотомическому пути (Barondes S., 1962).
Все эти данные отражают в какой-то степени состояние адаптационных механизмов при нейрогенном стрессе. На фоне изменённой функции симпато-адреналовой системы происходят изменения, направленные на сохранение энергообеспечения в самом чувствительном к нейрогенному стрессу органу – сердце, на устранение чрезмерной адренергической импульсации через повышение активности МАО в сердце.
Таким образом, анализ полученных данных показал, что на ранних этапах стрессорной реакции, как адаптационный механизм в сердце имеет место активация ферментов дыхательной цепи митохондрий: сукцинатдегидрогеназы, цитохром с-оксидазы и сопрягающего дыхание и фосфорилирование митохондриальной АТФ-азы. Изменения в других органах в этот момент, направлены на усиление адаптационных биоэнергетических процессов в сердце в ущерб собственной биоэнергетике.
На стадии декомпенсации, когда наступает истощение адренергической импульсации, снижение трансаденилатциклазного механизма субстратного обеспечения клеток и накопление метаболитов моноаминоксидазного окисления катехоламинов, нарушается скорость окисления субстратов в дыхательной цепи митохондрий, особенно сукцината, снижается уровень АТФ и его синтез, разобщается процесс окислительного фосфориолирования.
Одновременно идет интенсивное разрушение путем дезаминирования АМФ и других компонентов цикла пуриновых нуклеотидов, что повреждает воспроизводство внутритканевых вазолятаторов и приводит клетку к кислородной и энергетической задолженности, адаптационо переключающего метаболизм основного энергетического субстрата глюкозы на гликолитический и пентозофосфатный пути.
Нами обнаружено что на шестые сутки после нейрогеннного стресса в митохондриях сердца уже снижается активность СДГ, АТФ-азы, АМФ-дезаминазы, но активность МАО В-типа остается высокой. В митохондриях печени остается низкой активность СДГ и АМФ-дезаминазы. Активность ЦХО, АТФ-азы и МАО нормализуется. В митохондриях мозга нормализуется активность СДГ, АТФ-азы и МАО, снижается активность АМФ-дезаминазы. В митохондриях почек активность МАО В-типа остается повышенной, активность АМФ-дезаминазы снижается.
Эти данные свидетельствуют о наличии глубоких повреждений в сердце и начинающихся адаптационно – восстановительных процессах в других органах.
Исследованиями проведенные нами по изучению влияния стресса плавания и радиационного облучения животных было установлено, что целый ряд митохондриальных ферментов (сукцинатдегидрогеназа, цитохром с-окисдаза, АТФ-аза) меняют активность в зависимости от вида стрессорного воздействия и сроков.
При стрессе плавания в лимфоцитах и в безядерной фракции гомогенатов селезенки, во все сроки стресса имело место активация АТФ-азы, сукцинатдегидрогеназы (СДГ) и цитохром с-оксидазы. В печени после стресса плавания, как и в мозге, имело место активация СДГ, активность которой сохранялась на высоком уровне в течение 3 суток после стрессирования. Активность цитохром с-оксидазы в печени снижалась во все сроки наблюдения после стрессирования.
При радиационном стрессе в лимфоцитах и в безядерной фракции гомогенатов селезенки повышалась активность АТФ-азы и через 24 часа цитохром с-оксидазы. В безядерной фракции гомогенатов селезенки при радиационном стрессе снижалась активаность цитохром с-оксидазы и резко активировалась сукцинатдегидрогеназа. В головном мозге через 3 часа после стрессирования резко активировалась сукцинатдегидрогеназа, и АТФ-азы, которая затем снижалась. В мозге при радиационном стрессе имело место снижение активности цитохром с-оксидазы. В печени после радиационного облучения имело место активация СДГ и АТФ-азы в течение первых суток, которая затем снизилась к 30 суткам. А активность ЦХО в печени снижалась после облучения, затем повышалась к 3 суткам и вновь снижалась через 30 суток.
Анализ полученных данных показал, что, несмотря на разнотипность стрессирующих факторов, стрессорная реакция организма в разных тканях и клетках наиболее подверженных действию соответствующего стрессорного фактора однотипна.
На ранних этапах стрессорной реакции, как и в сердце, так и в лимфоцитах, в печени, в мозге, в селезенке, как адаптационный механизм, срабатывает активация ферментов дыхательной цепи митохондрий: сукцинатдегидрогеназы и сопрягающего дыхание и фосфорилирование митохондриальной АТФ-азы, которая сохраняется в лимфоцитах и отчасти в селезенке через 24 часа после стрессирования. В других клетках в более поздние сроки после стресса изменения активности ферментов не однотипны и имеют тенденцию к снижению биоэнергетических энерготрансформирующих процессов.
Все эти данные свидетельствуют о том, что при стрессе имеет место значительное истощение биоэнергетики клетки и, следовательно, возможность коррекции метаболических биоэнергетических процессов и восстановление измененных функций клеток и органов при стрессе, стимуляции адаптационных процессов, может быть обеспечена естественными регуляторами энергетического обмена.