
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Функциональные и метаболические эффекты симпато-адреналовой системы и стресс
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
6. Стресс и обмен пуриновых нуклеотидов
Известно, что на уровне клеток действует, как регуляторная, система пуриновых нуклеотидов и их производных (АТФ, АДФ, АМФ, аденозин, инозин, цАМФ), компоненты которых выступают в роли модуляторов. Служат универсальными внутриклеточными регуляторами не только нервно-мышечной, секреторной и других физиологических функций, но и регуляторами энергетического обмена и иммунной системы (Fox J. et al., 1972, Arch I.R. et al., 1978).
Установлено, что проявления функций клеток, обеспечивающие клеточный и гуморальный иммунитет, связаны с изменениями активности ферментов нуклеотидного обмена (Daddona P. еt al., 1980; Raivio K.O., 1980).
Особое значение в регуляции функции иммунокомпетентных клеток из системы пуриновых нуклеотидов занимают аденозин и цАМФ, хотя их содержание в лимфоцитах и лейкоцитах очень низко (Н.П. Дмитриенко, 1984).
Синтез цАМФ из АТФ катализируется ферментом аденилатциклазой, а превращение цАМФ в АМФ обеспечивается фосфодиэстеразой.
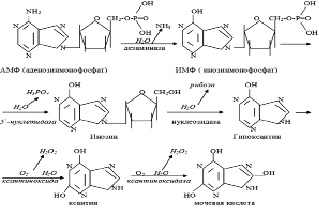
Рис. 9. Ферменты метаболизма пуриновых нуклеотидов
Аденозин синтезируется из АМФ под воздействием фермент (КФ.3.1.3.5.) 5`-нуклеотидазы (Stanley K. et al., 1980). Разрушение аденозина обеспечивается аденозиндезаминазой (Zuck V.U et al., 1990), приводящей к образованию инозина и аммиака.
Активность аденозиндезаминазы наиболее высока в лимфоидной ткани. В Т-лимфоцитах она 5–20 раз активнее, чем в В-лимфоцитах (Barton R. et al., 1979).
Аденозин в лимфоцитах может угнетать репликацию ДНК, снижает синтез пуринов. По мнению Wolberg G. (1975), аденозин является ингибитором цитолиза. Его ингибиторная активность коррелирует с повышением уровня цАМФ в лимфоцитах.
Полагают, что аденозин повышает уровень цАМФ в циркулирующих лимфоцитах в результате взаимодействия со специфическими мембранными рецепторами, приводящее к активации аденилатциклазы.
Аденозин добавленный к суспензии лимфоцитов в концентрации от 0,01 до 10 мкмоль (Marone G., et al., 1980) увеличивает в 4 раза уровень цАМФ. Инозин, аденин, гуанин такого эффекта не имеют.
Аденозин увеличивает уровень цАМФ в клетках многих типов, в том числе и иммунной системы, в различных субпопуляциях лимфоцитов (Н.П. Дмитриенко, 1984). Увеличение уровня цАМФ в Т-лимфоцитах под воздействием аденозина сопровождается угнетением их цитолитической функции против опухолевых клеток (Zenser T.V., 1975).
С увеличением уровня цАМФ в лимфоцитах связывают снижение синтеза ДНК и фосфорибозилпирофосфата – ключевого субстрата синтеза нуклеотидов, снижение пролиферации лимфоцитов (Wolberg G. et al., 1975).
Циклический АМФ влияет на экспрессию антигенов гистосовместимости на плазматических мембранах (Pincus J.H., et al., 1976). Вместе с тем, имеются наблюдения об увеличение содержания цАМФ в лимфоцитах в ранние сроки их активации митогеом (Parker C.W., 1976).
Таким образом, в иммунодепресивное и цитотоксическое действие аденозина вовлечена и аденилатциклазная система. Но цАМФ может служить не только отрицательным, но положительным регулятором функции лимфоцитов. Неодинаковая направленность эффектов цАМФ может быть обусловлена изменением его содержания в разных компартментах клеток иммунной системы (ядро, митохондрии, цитозоль и др.), функциями этих компартментов, обеспечиваюших биологические свойства лимфоцитов или других клеток.
Установлено, что аденозин способен уменьшать положительный инотропный эффект катехоламинов, угнетая сократимость и цАМФ-зависимую активацию протеинкиназы и гликогенфосфорилазы (Dobson J.G., 1980). Вместе с тем, аденозин может оказывать сходные с катехоламинами эффекты на сердце, но не влияет на образование молочной кислоты и уменьшает липолитическую активность катехоламинов (Rubio R., et al., 1974,), увеличивает коронарную проводимость, поглощение кислорода, использование глюкозы, оказывает положительное хронотропное действие (Seraydarian M. et al., 1972).
Аденозин оказывает гипногенное действие, подавляя активность корковых нейронов (Haulica I. et al., 1973), стимулирует синтез цАМФ в срезах головного мозга (Nimit Y. et al., 1981), восстанавливает сниженный уровень дофамина, норадреналина и серотонина (Е.М. Хватова и др., 1973).
В легочной ткани аденозин и АМФ в ответ на гипоксию оказывают сосудорасширяющее действие (Mentzer R.M., et al., 1975). Введение аденозина в дозе 50 мг/кг усиливает стероидогенез, повышая уровень кортикостероидных гормонов в крови (Formento M.L., et al., 1975). В опухолевых клетках возможно ингибирующее действие аденозина на аденилатциклазу.
В сердце при увеличении нагрузки или при действии детерминированного стрессом избытка катехоламинов уровнень АТФ и креатинфосфата снижается. Это приводит к активации 5`-нуклеотидазы и к возростанию образования аденозина из АМФ (Ф.Э. Меерсон, 1984).
Снижение уровня кислорода в крови стимулирует синтез аденозина миокардиоцитами (Berne R.M., 1980), который достигая артериол вызывает их дилатацию, увеличивает кровоток и следовательно, доставку кислорода и усиление синтеза АТФ и креатинфосфата. Повышение уровня этих макроэргов ингибирует 5`-нуклеотидазу, уменьшает выброс аденозина.
Таким образом, пуриновые нуклеотиды включаются в регуляцию не только отдельно взятых клеток иммунной системы, но и обеспечивают адаптационные механизмы многих других клеток, тканей и органов.
Ферментами, регулирующими уровень в клетке 3`5`-АМФ, АМФ, аденозина и инозина являются:
АТФ-аза (Е1), АМФ-дезаминаза (Е2),
5`-нуклеотидаза (Е3), аденозиндезаминаза (Е4),
ксантинкосидаза (Е5), аденилатциклаза (Е6):
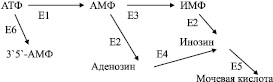
Проведенными нами исследованиями установлено, что стресс, вызванный трехчасовой электростимуляцией дуги аорты приводит к резкому снижению уровня цАМФ (3`5`-АМФ) и активности аденилатциклазы в клетках сердца. При этом в сердце возрастает активность митохондриальной Mg-АТФ-азы, АМФ-дезаминазы, а в митохондриях печени повышается активность АМФ-дезаминаза (С.О. Тапбергенов, 1984).
Активация АМФ-дезаминазы обнаружена при гипоксии, холодовом стрессе в митохондриях мозга (И.А. Горошанская, 1992). Увеличение активности Na-К-АТФ-азы при ишемии миокарда имело место в головном мозге (Т.Г. Сазонтова и др., 1984), угнетение в легких и тяжелых синаптосомах мозга (В.В. Давыдов и др., 1984) и в митохондриях мозга при физической нагрузке (А.Г. Васильева, 1992).
По данным Л.И. Дворецкого и соавт. (1984), ионизирующая радиация, как вариант стрессорного воздействия на организм, может привести к активации Na, К-АТФ-азы мембран селезенки, и к снижению активности АТФ-азы митохондрий (А.Т. Иващенко, 1981).
При облучении животных в летальной и сублетальной дозах в мозге наблюдали активацию Nа, К-АТФ-азы (Т.Г. Сазонтова и др., 1984). Однако, большинство наблюдений показывает, что при облучении организма активность Nа, К-АТФ-азы снижается в мембранной фракции головного мозга (К.Ш. Нодарейшвили и др., 1989), в синаптосомах (Н.А. Водолазская и др., 1989), в гомогенатах печени (Е.М. Васютинская и др., 1986) в митохондриях и ядрах гепатоцитов (С.Т. Рыскулова и др., 1976).
В печени облученных животных имело место снижение активности АМФ-дезаминазы (И.Н. Литовченко, 1980, И.В. Савицкий, 1980).
Активность фермента 5`-нуклеотидазы повышается при облучении в митохондриях печени и головного мозга (И.В. Савицкий, 1990, Е.А. Положий, 1989, С.Т. Рыскулова и др., 1976). При более мощном облучении активность 5`-нуклеотидазы в этих органах снижается (И.В. Савицкий, 1980, И.Н. Литовченко, 1986).
В сравнительном аспекте нами было изучено влияние нейрогенного стресса, вызванного 60-минутным плаванием при температуре 30 °С и стресса, вызванного однократным облучением животных, который вызывали общим гамма-облучением кобальтовой пушкой «Агат-60» в дозе 6 Гр с мощностью дозы 0,6 Гр/мин, при открытом коллиматоре и кожно-фокусном расстоянии 70 см, на фементы обмена пуриновых нуклеотидов в лимфоцитах и в без ядерной фракции гомогенатов селезенки, печени и головного мозга, в сывороке крови.
Исследованиями установлено, что в головном мозге животных, стресс плавания приводит к активации Nа, К-АТФ-азы и 5`-нуклеотидазы, которая сохраняется в течение 24 часов, а затем снижается. Активность аденозиндезаминазы и АМФ-дезаминазы вначале снижается. Низкий уровень активности сохраняется в течение 24 часов, затем активность аденозиндезаминазы нормализуется, а АМФ-дезаминазы повышается.
Примерно аналогичны изменения активности вышеперечисленных ферментов в мозге и при радиационном стрессе.
В печени на ранних стадиях нейрогенного стресса имело место снижение активности аденозиндезаминазы и АМФ-дезаминазы, а снижение АТФ-азы имело место на 2–3 сутки.
Облучение в печени животных привело к активации Nа, К-АТФ-азы и 5`-нуклеотидазы во все сроки наблюдения (от 3 часов до 30 суток). Активирование аденозиндезаминазы произошло через 24 часа, а затем активность фермента снизилась. Напротив, активность АМФ-дезаминазы вначале снизилась, а затем имело место активация, которая исчезла к 30 суткам после облучения животного.
Исследованиями установлено, что в лимфоцитах селезенки при нейрогенном стрессе, в первые 3–48 часов после стрессирования резко активируется Nа, К-АТФ-аза и 5`-нуклеотидаза. Активность аденозиндезаминазы и АМФ-дезаминазы снижается. При радиационном стрессе в лимфоцитах селезенки имело место активация Nа, К-АТФ-азы и АМФ-дезаминазы и снижение активности 5`-нуклеотидазы и аденозиндезаминазы.
В безядерной фракции гомогената ткани селезенки нейрогеный стресс приводит к активации Nа-К-АТФ-азы, аденозиндезаминазы и АМФ-дезаминазы в сроки до 48 часов после стрессирования, а активность 5`-нуклеотидазы в течение всего срока наблюдения оставалась сниженной.
Радиационный стресс вызвал снижение Nа, К-АТФ-азы, 5`-нуклеотидазы и аденозиндезаминазы в селезенке в течение всего периода наблюдения (30 суток). Активность АМФ-дезаминазы в гомогенате селезенки повышалась к первым 3 часам после облучения, к 24 часу снизилась, а затем нормализовалась.
В плазме крови при нейрогенном стрессе имело место значительная активация 5`-нуклеотидазы и АМФ-дезаминазы в течение 2 суток после стрессирования, аденозиндезаминазы через 3 часа. Активность Nа, К-АТФ-азы снизилась через 3 часа после стрессирования.
При радиационном стрессе в плазме крови изменения активности АТФ-азы имели волнообразный характер: через 3 часа снижение, через 24 часа – активация, затем нарастало снижеие активности. Активность 5`-нуклеотидазы снизилась на 3 сутки, аденозиндезаминазы – через 3 часа. АМФ-дезаминаза активировалась через 24 часа после облучения.
Анализ полученных в наших экспериментах данных показал, что при нейрогенном стрессе в лимфоцитах селезенки в результате изменений активности ферментов пуринового обмена может накапливаться аденозин, который, согласно литературным данным, приводит к угнетению функции лимфоцитов. Характерными изменениями для плазмы крови является повышение активности АМФ-дезаминазы и 5`-нуклеотидазы, на фоне нестабильных изменений остальных ферментов пуринового обмена. Эти изменения ярче выражены при нейрогенном стрессе, чем при облучении.
В сравнительном плане, нами было изучено изменения активности АМФ-дезаминазы при инфаркте миокарде и при стенокардии, как разновидностях нейрогенных стрессорных состояниях у человека (табл. 13).
Таблица 13
Активность АМФ-дезаминазы крови при инфаркте миокарда и при стенокардии покоя
|
Група |
АМФ-дезаминаза |
АМФ-АТФ дезаминаза |
|
Норма (контроль) |
22,65 ± 3,89 |
29,08 ± 6,63 |
|
Свежий инфаркт миокарда |
85,73 ± 4,95* |
127,16 ± 8,98* |
|
20–25 день после ифаркта |
14,65 ± 2,63* |
19,19 ± 5,77* |
|
Стенокардия покоя |
57,28 ± 13,42* |
– |
Примечание: * – достоверность Р < 0,001 в сравнении с контролем.
При стенокардии покоя и при свежем инфаркте миокарда обнаружено резкое повышение активности АМФ-дезаминазы в сыворотке крови. Эти данные позволяют рекомендовать определение активности АМФ-дезаминазы для диагностики инфаркта миокарда (Тапбергенов С.О., Тапберенова С.М., 1984).
При операционном стрессе изучена активность ферментов цикла пуриновых нуклеотидов у детей и взрослых. У детей предоперационный стресс приводит к резкому возрастанию активности аденозиндезаминазы и АМФ-дезаминазы в лимфоцитах крови (табл. 14) и к снижению коэффициентов А и В.
На 1 сутки после операции в лимфоцитах крови детей повышается активность 5`-нуклеотидазы (5`НТ) и сохраняется сниженными коэффициенты А и В. На 5 сутки после операции на фоне снижения активности аденозиндезаминазы и АМФ-дезаминазы, резко возрастает активность 5`НТ (почти в 2 раза выше, чем до операции) и увеличивается коэффициент А. При этом коэффициент В остается низким.
Таблица 14
Активность ферментов цикла пуриновых нуклеотидов в лимфоцитах детей при операционном стрессе
|
Ферменты |
Контроль |
До операции |
1 сутки после операции |
5 сутки после операции |
|
Аденозин |
0,0069 ± 0,0022 |
0,0342 ± 0,0099* |
0,0302 ± 0,0170* |
0,0173 ± 0,0014* |
|
АМФ-дезаминза |
0,0032 ± 0,0011 |
0,0335 ± 0,0036* |
0,0213 ± 0,0116* |
0,0135 ± 0,0026* |
|
5’НТ |
0,0181 ± 0,0064 |
0,0173 ± 0,0042 |
0,0260 ± 0,0089* |
0,0462 ± 0,0021* |
|
Коэффициент А |
2,287 ± 0,527 |
0,468 ± 0,131* |
1,466 ± 0,974 |
3,308 ± 1,065* |
|
Коэффициент В |
6,054 ± 1,945 |
0,978 ± 0,234* |
1,502 ± 0,744* |
1,301 ± 0,209* |
Примечание: * – достоверность Р < 0,001 в сравнении с контролем.
Снижение коэффициентов А и В до операции и на 1 сутки после операции сопровождается уменьшением концентрации АМФ и аденозина, и возрастанием ИМФ в лимфоцитах. Это приводит к ограничению Т-хелперной активности и к возрастанию Т-супрессии, то есть приводит к функциональной неполноценности клеточного иммунитета, приближающейся к иммунодефициту.
Накопление этих метаболитов приводит к стимуляции синтеза МIF-фактора, увеличивается реакция торможения миграции макрофагов (нормальная Т-хелперная реакция), и через активацию аденозином и ИМФ аденилатциклазы Т-супрессоров, происходит умеренное снижение образования циркулирующих иммунных комплексов В-лимфоцитами, то есть происходит восстановление адекватной иммунной реакции на операционный стресс.
У взрослых до операции (табл. 15) повышается активность АДА, АМФ-ДА и 5`НТ в лимфоцитах.
Таблица 15
Активность ферментов цикла пуриновых нуклеотидов в лимфоцитах взрослых при операционном стрессе
|
Ферменты |
Контроль |
До операции |
1 сутки после операции |
5 сутки после операции |
|
АДА |
0,0396 ± 0,0065 |
0,0745 ± 0,0075* |
0,0474 ± 0,0196 |
0,0286 ± 0,0057 |
|
АМФ-ДА |
0,0323 ± 0,0086 |
0,0823 ± 0,0392* |
0,0095 ± 0,0058* |
0,0704 ± 0,0086* |
|
5`НТ |
0,0488 ± 0,0110 |
0,1532 ± 0,0611* |
0,1355 ± 0,0405* |
0,1913 ± 0,0152* |
|
Коэффициент А |
1,580 ± 0,480 |
2,502 ± 1,032 |
5,107 ± 2,386* |
2,176 ± 0,474 |
|
Коэффициент В |
1,234 ± 0,198 |
1,092 ± 0,596 |
6,367 ± 1,368* |
1,498 ± 0,126 |
Примечание: * – достоверность Р < 0,001 в сравнении с контролем.
На 1 сутки после операции повышается активность АМФ-ДА и 5`НТ, повышаются коэффициенты А и В, что свидетельствует о сохранности функциональной взаимосвязи клеточного и гуморального звенаиммунитета, о нормальной реактивности клеточного иммунитета и адекватного Т-хелперного ответа. На 5 сутки после операции, уровень коэффициентов А и В достигают уровня нормы при низком уровне активности АМФ-дезаминазы и активации 5`НТ. В целом, все эти данные показывают хотя и на особенности влияния операционного стресса, но и на однонаправленность изменений активности ферментов метаболизма пуринов и иммунный статус у детей и взрослых.
Аналогичные данные были получены и при оксидативном стрессе (Chalmers A.H. et al., 2000).
Таким образом, анализ собственных исследований и литературных данных показал на однонаправленность изменений активности ферментов метаболизма пуриновых нуклеотидов при нейрогенном и других видах стресса.
Определение активности аденозиндезаминазы, 5`-нуклеотидазы и АМФ-дезаминазы, контролирующих уровень аденозина, может быть использовано для как оценки иммунного статуса, так и для диагностики нейрогенных поражений миокарда (С.О. Тапбергенов, С.М. Тапберенова, 1984).