
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
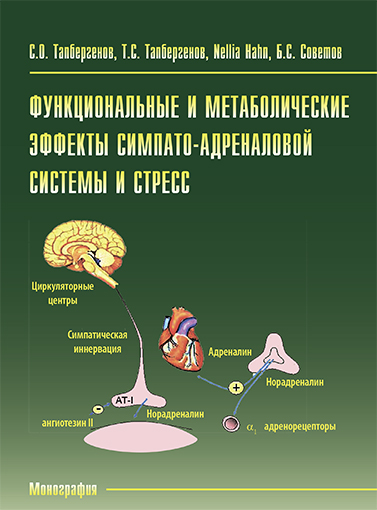
Функциональные и метаболические эффекты симпато-адреналовой системы и стресс
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
7.2. Метод определения активности АМФ-дезаминазы
Фермент АМФ-дезаминаза (аденозинмонофосфат дезаминаза, КФ 3.5.4.6, AMPD) существует в нескольких формах: М (мышечная, AMPD1), L (печёночная АМРD2), Е (эритроцитарная, AMPD3). Тип М (AMPD1) специфичен для скелетной и сердечной мышц. Недостаточность миоаденилат дезаминазы – наиболее частая причина метаболических миопатий (мышечная слабость и подёргивания после физической нагрузки). Заболевание характеризуется мышечными болями при физической нагрузке, судорогами и/или быстрой утомляемостью.
Тип Е (AMPD3). Мутантные аллели широко распространены в Японии, Корее, Восточной Европе (носитель – каждый тридцатый житель). Клинические проявления недостаточности эритроцитарной формы фермента не обнаружены. Отсутствие активности изоформы AMФ-деаминазы эритроцитов было описано у пациентов с низким уровнем мочевой кислоты в плазме.
Определение активности АМФ-дезаминазы (С.О. Тапбергенов, С.М. Тапбергенова, 1984)
Принцип метода
АМФ-дезаминаза (АМФ-ДА) – катализирует гидролитическое дезаминирование АМФ в ИМФ с освобождением аммиака (NH3). Метод определения активности этого фермента основан на количественном определении аммиака, освобождающегося при дезаминировании АМФ. По количеству освободившегося NH3 за 30 минут судят об активности ферментов. Количество аммиака определяется в среде инкубации без его предварительной отгонки с помощью цветной реакции Бертло. Из всех способов определения аммиака фенол нитропруссид гипохлоридная реакция Бертло, является наиболее чувствительной и специфичной и основана на реакции между фенолом и гипохлоридом в щелочной среде. Трис, его следы – подавляют развитие цветной реакции.
Реактивы:
1. 0,05 М фосфатный буфер: 50 мл 0,2 М KH2PO4 + 39,2 мл 0,2 М NaOH до 200 мл дист. водой.
2. 0,2 М КН2РО4: 27,22 г – 1000 мл дист. воды или 13,61 г – 500 мл дист. воды.
3. 0,2 М NaOH: 8 г NaOH – 1000 мл дист воды или 4 г NaOH – 500 мл дист. воды.
4. 0,05 М MgCl2: 4,76 г MgCl2 – 1000 мл дист. воды или 2,38 г MgCl2 – 500 мл дист. воды.
5. 1М KCl: 74,56 г – 1000 мл дист. воды или 37,28 г – 500 мл дист. воды.
6. Реактив № 1: 5 г перегн. фенола + 62,5 мг нитропруссида натрия, до 500 мл дист. водой.
7. Реактив № 2: 50 г Na3PO4 12H2O + 10 мл гипохлорида Na до 500 мл дист. воды.
8. Приготовление гипохлорида натрия (NaClO) удобнее всего получать реакцией между продажной хлорной известью и углекислым натрием:
СаОСl2 + Na2CO3 = CaCO3 + NaClO + NaCl.
Тщательно размешивают 100 г хлорной извести с содержанием активного хлора 35–36 % с 170 мл дистиллированной воды в течение 15 мин и в смесь при непрерывном помешивании вносят раствор 70 г Na2CO3 (тех. сода) в 170 мл воды. Масса сначала густеет, затем опять разжижается. Жидкость отсасывают от осадка через полотняный фильтр. Получается 320 мл раствора гипохлорида натрия с содержанием активного хлора 71–100 г/л.
В день опыта приготовить:
1. Среда инкубации: 60 мл 0,05 М MgCl2 + 4,32 мл 1 М KCl + до 300 мл фосфатный буфер (рН – 7,4).
2. АМФ 0,75 %: 30 мг + 4 мл фосфатного буфера.
Ход определения
Для одного анализа необходимо 2 пробирки.
В первую пробирку вносят 1,5 мл среды инкубации, 0,1 мл биоматериала, 0,2 мл АМФ. (активности АМФ-дезаминазы).
Во вторую пробирку (контрольную) вносят 1,5 мл среды инкубации, 0,1 мл биоматериала (контроль ткани на содержание аммиака).
Все пробы инкубируют 30 мин при 37 °С, в термостате в течение 180 мин, затем быстро добавляют холодных реактивов № 1 и № 2 по 2 мл. Через 30 минут при 37 °С в термостате развивается устойчивая на протяжении 24 часов окраска, интенсивность которой пропорциональна количеству образовавшегося аммиака. Все пробы центрифугируют при 3000 об/мин, в течение 10 мин. Прозрачный надосадочный раствор колориметрируют на КФК при длине волны 540 нм, кювета 10 мм, против дист. воды.
Количество аммиака в пробе рассчитывают по калибровочному графику, который строят по стандартным растворам сернокислого аммония. С учетом разницы опыта и контроля рассчитывают активность фермента.
Активность выражают в нмоль аммиака на 1 мг белка. Метод отличается высокой чувствительностью и аналитической надежностью, но при его использовании следует соблюдать все правила работы с ферментами.
Расчет активности АМФ-дезаминазы
Удельная активность АМФ-дезаминазы, рассчитывается в нмолях аммиака (NH3 определяют по калибровочному графику), образовавшегося в 1 мин (или сек), при 37 °С на мг белка, по следующей формуле:
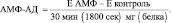
● единица измерения активности фермента: нмоль NH3, в мин на (мг) белка.