
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.6. Алканы. Циклоалканы
В традиционной классификации органических веществ алканы и циклоалканы относятся к углеводородам.
Углеводороды – это органические вещества, состоящие только из двух элементов – углерода и водорода. Углеводороды подразделяются на циклические (с замкнутыми молекулярными цепями) и ациклические (с незамкнутыми молекулярными цепями). Например:

циклобутан бутан
(циклический углеводород) (ациклический углеводород)
Углеводороды, молекулы которых образованы с помощью только ординарных связей, называются предельными (насыщенными) углеводородами.
Предельные ациклические углеводороды называются алканами или парафинами. Простейшим алканом является метан, молекулярная формула которого СН4.
Для того, чтобы разобраться в строении метана необходимо вспомнить особенности электронного строения атома углерода.
Атом углерода в невозбуждённом состоянии включает в себя два спаренных s – электрона на первом энергетическом уровне, два спаренных s-электрона на втором энергетическом уровне и два неспаренных р-электрона на том же втором энергетическом уровне (рис. 2.1)
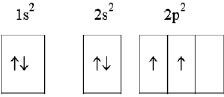
Рис. 2.1. Схема электронного строения атома углерода в невозбуждённом состоянии
Но при образовании органических соединений углерод получает дополнительную энергию, в результате чего становится обладателем четырёх неспаренных электронов, способных к взаимодействию (рис. 2.2).
Причём, один из них s-электрон, вращающийся по сферической s-орбитали, и три p-электрона, вращающихся по трём гантелеобразным р-орбиталям (рис. 2.3).
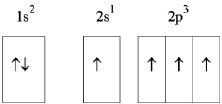
Рис. 2.2. Схема электронного строения атома углерода в возбуждённом состоянии
Казалось бы, будучи четырёхвалентным, возбуждённый углерод не может образовывать с атомами водорода четырёх одинаковых связей, поскольку формы s-орбитали и р-орбитали существенно различаются. Однако, все экспериментальные измерения неизменно указывали на эквивалентность всех четырёх углерод – водородных связей в молекуле метана. Объяснение этому факту удалось найти только после открытия явления гибридизации атомных орбиталей. Оказалось, что в предельных углеводородах все атомы углерода обладают sp3-валентными электронами, то есть электронами, вращающимися по четырем гибридизованным sp3-орбиталям (рис. 3).
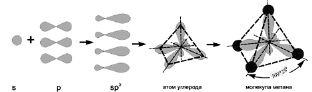
Рис. 2.3. Схема гибридизации атомных орбиталей возбуждённого атома углерода и образования молекулы метана[24]
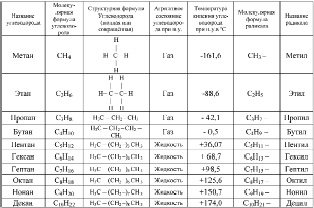
Все алканы описываются общей формулой СnH2n+2 (где n – целое положительное число), образуя между собой гомологический ряд, каждый представитель которого отличается от предыдущего на группу CH2, называемую гомологической разницей. Органические вещества, отличающиеся друг от друга на одну или несколько групп CH2 называются гомологами. Первые десять гомологов предельных углеводородов неразветвлённого (нормального) строения указаны в табл. 2.1. В этой же таблице приведены названия радикалов – частиц, образованных отщеплением от органической молекулы атома водорода. Радикалы не являются молекулами. Они представляют собой неустойчивые «осколки», приобретающие стабильность только в составе целой молекулы. Название большинства радикалов предельных углеводородов, образовавшихся отщеплением одного атома водорода, формируется заменой суффикса –ан, на –ил.
Для составления названия разветвлённых предельных углеводородов придерживаются следующих правил:
1. Выбирают в структурной формуле наиболее длинную углеродную цепь и нумеруют в ней символы атомов углерода, начиная с того конца, к которому ближе разветвление.
2. Называют заместители (начиная с простейшего) и при помощи цифр указывают их место у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых заместителя, тогда номер повторяют дважды. Число одинаковых заместителей указывают при помощи чисел на греческом языке («ди» – два, «три» – три, «тетра» – четыре, «пента» – пять и т. д.). Например:
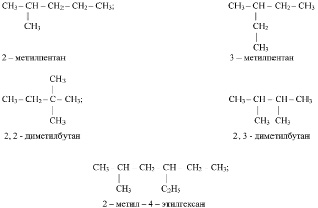
Таблица 2.1
Гомологический ряд предельных углеводородов (ряд метана)
Приведённые правила были разработаны международным союзом теоретической и прикладной химии – International Union of Pure and Applied Chemistry, сокращённо IUPAC (ИЮПАК). В дальнейшем, названия веществ, составленные в соответствии с этими правилами будем называть систематическими. Однако, по сей день наряду с систематическими названиями нередко используются названия традиционные (тривиальные), сложившиеся задолго до возникновения IUPAC. Например, систематическое название продукта реакции (18) (2-метилбутан) и его тривиальное название (изопентан) используются одинаково часто.
Физические свойства
Как видно из таблицы, первые четыре гомолога предельных углеводородов представляют собой газы при нормальных условиях. Алканы неразветвлённого строения находятся в жидком агрегатном состоянии начиная с пентана и вплоть до углеводорода С15Н32 (пентадекан). Начиная с гексадекана (С16Н34), алканы нормального строения – твёрдые вещества. Первым твёрдым разветвлённым насыщенным углеводородом является 2,2,3,3 – тетраметилбутан. В целом, температура кипения алканов повышается с увеличением массы и разветвлённости макромолекулы.
Химические свойства
Под химическими свойствами органических веществ в настоящем курсе будем подразумевать их способность вступать в реакции соединения, разложения, замещения, обмена, рассматривая в качестве критерия классификации состав исходных веществ и продуктов реакции. Хотя, следует иметь в виду, что разнообразие превращений органических веществ настолько велико, что не укладывается в узкие рамки указанной классификации. В частности, приведённая выше реакция изомеризации (2.18) не может быть отнесена ни к одной из перечисленных групп. Кроме того, процессы соединения и разложения могут протекать одновременно в одной и той же реакции. Например, при нагревании метана до 1500 °С образуются ацетилен и водород:
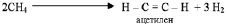 (2.19)
(2.19)
То есть, с одной стороны происходит отщепление водорода, а с другой стороны, атомы углерода соединяются в одну молекулу тройной связью.
Реакции соединения. Для алканов реакции соединения не характерны. Валентности молекул этих веществ проявляют себя насыщенными до предела. Именно поэтому их стали называть насыщенными или предельными углеводородами.
Реакции разложения. Примером реакций разложения алканов может служить образование углерода и водорода при нагревании метана до температуры свыше 1000 °С без доступа воздуха:
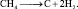
Если в этих же условиях метан нагреть до 1500 °С протекает реакция (2.19).
Этан при разложении может образовывать этилен и водород (реакция дегидрирования):
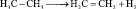
этилен
Однако, следует иметь в виду, что в отсутствие воздуха для любого алкана можно подобрать температуру и давление при которых он распадётся на углерод и водород:
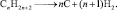
Реакции замещения. При освещении смеси метана с Cl2, водород замещается атомами хлора:
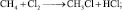
хлорметан

дихлорметан

трихлорметан
(хлороформ)

тетрахлорметан
Атомы или радикалы, замещающие водород в молекулах углеводорода иногда называют заместителями. В хлорметане, дихлрметане, трихлорметане и тетрахлорметане заместителем является хлор. А в 2-метилбутане (реакция (2.18)) в качестве заместителя одного из атомов водорода бутана можно воспринимать метил. Метан легко сгорает бесцветным пламенем, в результате чего атомы водорода замещаются атомами кислорода:

Накапливаясь в угольных шахтах метан образует с воздухом взрывчатую смесь, несвоевременное обнаружение которой приводит порой к несчастным случаям.
Следует иметь в виду, что если в качестве критерия классификации принять изменение степени окисления у атомов взаимодействующих молекул, то рассмотренные выше реакции разложения и замещения можно рассматривать как окислительно-восстановительные. При этом, восстановителем во всех случаях служит атом углерода, а окислителем – атомы водорода, хлора и кислорода. Подавляющее число органических реакций являются окислительно-восстановительными.
Реакции обмена. При 800–900 °С и в присутствии катализаторов (Ni, MgO или Аl2O3) метан взаимодействует с водой и углекислым газом:


Предельные циклические углеводороды с общей молекулярной формулой СnH2n называются циклоалканами:
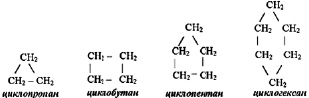
Иногда структурные формулы циклоалканов представляют простыми геометрическими фигурами
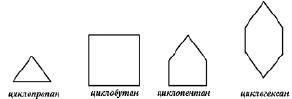
Каждый угол таких многоугольников символизирует углерод, соединённый с двумя атомами водорода σ – связью:
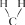
Физические свойства
Циклопропан и циклобутан при нормальных условиях – газы, а циклопентан и циклогексан – жидкости.
Химические свойства
Основное отличие химических свойств циклоалканов от химических свойств алканов состоит в способности вступать в реакции соединения:
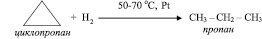
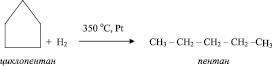
Поведение циклоалканов при разложении, их свойство вступать в реакции замещения и обмена аналогичны поведению и свойствам алканов.
Хотя способность циклоалканов вступать в реакции присоединения сближает их с непредельными углеводородами, однако главным критерием классификации органических веществ является их строение. Поскольку молекулы циклоалканов образованы с помощью только ординарных связей, то они относятся к предельным углеводородам.
1. Определить степени окисления всех элементов исходных веществ и продуктов реакции взаимодействия:
– метана с кислородом;
– метана с водой;
– метана с углекислым газом.
2. Какой из элементов метана является окислителем, а какой восстановителем в процессе его разложения на углерод и водород. Почему?
3. Дайте систематические названия следующим соединениям:
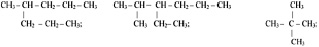
4. Составьте структурную формулу первого твёрдого разветвлённого алкана (2,2,3,3 – тетраметилбутан).
5. В чём состоит основное отличие химических свойств циклоалканов от химических свойств алканов. Приведите примеры.
