
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.1.2. Роль протеолитического процессинга паратгормон-родственного белка в формировании его биологически активных пептидных доменов
В течение трех последних десятилетий структурно-родственные биологически активные молекулы семейства паратгормона стали предметом растущего интереса, и среди них особое внимание исследователей привлекает ПТГрП (Schluter K.D., 1999).
Молярная масса ПТГрП – 20194 Да.
Пространственная модель NH2-терминального домена ПТГрП (1–34) человека (рис. 1).
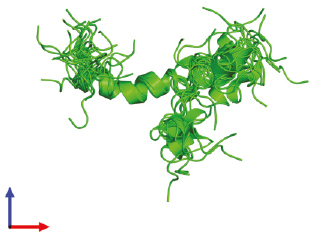
Рис. 1. Структура N-концевого домена (1–34) человеческого
паратгормон-родственного белка, в почти физиологическом растворе
(RCSB BPD – 1BZG) Weidler M., Marx U.C., Seidel G., Schafer W.,
Hoffmann E., Esswein A., Rosch P. FEBS Lett. 1999; 444 239-44
Представлена структура биологически активного NH2-терминального домена ПТГрП (1–34) человека, определенная с помощью двухмерной протонной магнитно-резонансной спектроскопии. Улучшенная стратегия расчета структуры показала наличие двух спиралей His-5-Leu-8 и Gln-16-Leu-27, связанных гибким линкером. (Weidler M. et al., 1999). N-концевые домены ПТГ (1–34) и ПТГрП (1–34) в значительной степени сохраняются в эволюции, имеют большую степень структурной гомологии, причем восемь из первых 13 начальных аминокислотных остатков (Val2, Ser3, Glx4, Gln6, Leu7, His9, Gly12 и Lys13) идентичны (Philbrick W.M. et al., 1996) и имеют высокую степень прогнозируемой вторичной структуры в следующих 21 аминокислотном остатке (Barden J.A., Cuthbertson R.M., 1993; Ray F.R. et al., 1993), что имеет важное значение для связывания рецептора и трансдукции гормонального сигнала (Gardella T.J., Juppner H., 2001; Gensure R.C. et al., 2005). ПТГрП в значительной степени консервативен у большинства видов, однако альтернативный сплайсинг продуцирует три уникальные изоформы человеческого ПТГрП, которые дифференциально
экспрессируются в определенных тканях (McCauley L.K., Martin T.J., 2012). Точные цели и характеристики этих изоформ не выяснены на данном этапе (Yang K.H. et al., 1994). Тем не менее, наличие различных мотивов нестабильности между изоформами мРНК позволяет предположить, что каждый из них обладает различными периодами полураспада и что некоторые из них могут быть более подходящими для функционирования в качестве паракринного или аутокринного медиатора, в отличие от более традиционных эндокринных активностей, связанных с ПТГ (Martin T.J., 2016). Альтернативное сплайсинг генерирует несколько разных видов мРНК, которые кодируют три отдельные изоформы белка. В различных изоформах молекула ПТГрП содержит 139, 141 либо 173 аминокислотных остатка (Thiede M.A., Rodan G.A., 1988; Mangin M. et al., 1988). Исходные продукты трансляции, образующие изоформы ПТГрП, различаются, в основном, за счет С-концевого фрагмента. Первые 111 аминокислот ПТГрП являются чрезвычайно консервативной частью структуры молекулы у многих видов. На аминокислотном уровне ПТГрП куриных имеет 91 % сходство с ПТГрП человека, ПTГрП рыбы фугу имеет 53 % сходство с человеческим ПТГрП (Danks J.A. et al., 2003).
ПТГрП млекопитающих имеют области, которые являются потенциальными сайтами посттрансляционной обработки ферментативным расщеплением, амидированием и гликозилированием (Orloff J.J. et al., 1994), генерируя несколько доменов с различными физиологическими функциями. Было также высказано предположение, что полноразмерный белок ПТГрП (139, 141 или 173 аминокислоты) фактически является белком-предшественником, который может быть трансформирован в различные биоактивные пептиды. Наличие множества предсказанных моно- и многоосновных сайтов расщепления в последовательности белка ПТГрП указывает на то, что он, вероятно, подвержен протеолитическому гидролизу (Orloff J.J. et al., 1994).
Исследования белковой последовательности показали, что ПТГрП чувствителен к посттрансляционному протеолитическому расщеплению несколькими классами протеаз, и появляются новые данные, указывающие на новые функциональные роли этих продуктов ПТГрП в регуляции поведения клеток в гомеостатическом и патологическом контекстах. Как следствие, продукты процессинга ПТГрП также исследуются в качестве потенциальных биомаркеров заболевания (Frieling J.S., Lynch C.C., 2019). Как важный компонент функционирования живых организмов, протеазы ответственны за процессинг белков путем гидролиза пептидных связей. Эволюционно протеазы, вероятно, возникли как механизм катаболизма белков и облегчения образования аминокислот (Lopez-Otin C., Bond J.S., 2008). Широкий спектр дополнительных функций протеаз в биологии также был изучен и в том числе их способность регулировать функцию белков путем создания уникальных, биологически активных форм. Эти аспекты протеазной активности открыли новую область исследований под названием деградомика (Fingleton B., Lynch C.C., 2002). На сегодняшний день идентифицировано более 580 протеаз человека, которые классифицируются на основе их каталитических механизмов и в совокупности функционируют как «протеазная сеть» (Turk B., 2006; Fortelny N. et al., 2014; Kappelhoff R. et al., 2017). Многие из этих протеаз могут потенциально нацеливаться на ПТГрП на основании предсказанного расщепления аминокислотных последовательностей.
Ферменты семейства сериновых протеаз: пропротеин-конвертазы 1 (PC1/3), PC2, фурина, PC4, PC5, парного основного расщепляющего аминокислоты фермента 4 (PACE4), PC7, гидролизуют белки в локусах аминокислот лизин, аргинин и гистидин, многие из которых часто встречаются в аминокислотной последовательности ПТГрП (Orloff J.J. et al., 1994; Hendy G.N. et al., 1995). Распределение эндопептидазы (PTP) (прогормон-тиол-протеаза), пропротеин-конвертаз 1 и 2 (PC1 и PC2) может различаться в разных тканях (Deftos L.J. et al., 2001). Фурин участвует в процессинге про-белков по конститутивному секреторному пути, используемому для секреции ПТГрП, и обеспечивает удаление пре-про-областей как ПТГ, так и ПТГрП. Высоко консервативная последовательность Arg-Leu-Lys-Arg, которая находится между pro-ПТГрП и ПТГрП, является предсказанным сайтом расщепления фурином, и исследования подтвердили, что ПТГрП является субстратом фурина. Эти наблюдения были сделаны путем экспрессии pro-ПТГрП в клеточной линии COS-7, которая эндогенно экспрессирует фурин, в результате чего высокие уровни ПТГрП секретируются в кондиционированную среду для культивирования клеток. Совместная трансфекция клеток как pro-ПТГрП, так и антисмысловой кДНК фурина снижала секрецию активного ПТГрП (Liu B. et al., 1995). Учитывая повсеместное присутствие в тканях и частую субклеточную локализацию в аппарате Гольджи, фурин, вероятно, является ключевым ферментом для внутриклеточной обработки и секреции активного ПТГрП.
Протеиновые конвертазы могут осуществлять протеолиз ПТГрП и в других участках его аминокислотной последовательности. Известно, что протеаза кексин, ортологичная к субтилизин-подобным сериновым протеазам человека, расщепляет ПТГрП (1–141) в локусе с тройным аргинином 19–21. Также было показано, что кексин гидролизует ПТГрП в местах локализации аминокислот 97, 105, 106 и 108, поэтому они могут представлять дальнейшие предполагаемые сайты расщепления фурина (Diefenbach-Jagger H. et al., 1995). Интересно, что расщепление молекуды белка в локусе аминокислотного остатка 106 способствует генерации пептида остеостатина ПТГрП (107–139). Фермент неприлизин играет важную роль в процессе развития, основываясь на его способности инактивировать сигнальные пептиды (Roques B.P. et al., 1993; Turner A.J., Tanzawa K., 1997; Maguer-Satta V. et al., 2011). Подобно PSA, неприлизин расщепляет ПТГрП (1–34) с образованием ПТГрП (1–23) и ПТГрП (1–26).
Кроме того, неприлизин также расщепляет остеостатин (ПТГрП 107–139) с образованием фрагментов ПТГрП (107–133) и ПТГрП (133-139) (Ruchon A.F. et al., 2000). Поскольку аминокислоты 107–111 содержат остатки ядра остеостатина, возможно, что генерируемый неприлизином ПТГрП (107–133) сохраняет активность, приписываемую остеостатину.
Сообщалось, что ПТГрП (1–36) (или 1–34) является зрелой формой ПТГрП, образующейся вследствие протеолиза аминокислотного остатка аргинина в положении 37 полноформатной молекулы ПТГрП, (Liu B. et al., 1995; Soifer N.E. et al., 1992). Однако протеазы, участвующие в образовании ПТГрП (1–36), остаются плохо идентифицированными и, вероятно, зависят от контекста ткани. Большинство классических биологических активностей, приписываемых ПТГрП, таких как регуляция дифференцировки остеобластов (Miao D. et al., 2005; Chen H.L. et al., 2002)
и стимулирование образования остеокластов путем стимуляции остеобластов с образованием RANKL (Miao D. et al., 2005), относятся к ПТГрП (1–36). Хотя ПТГрП (1–36) часто принимается в качестве основной формы активного ПТГрП, более короткие N-концевые пептиды PTHrP в этой области также были обнаружены. Так, пептид ПТГрП (1–23) может генерироваться из ПТГрП1–141 человеческим калликреин-3 / простат-специфическим антигеном (hk3/PSA), сериновой протеазой, наиболее часто ассоциируемой с раком простаты в качестве биомаркера (Cramer S.D. et al., 1996). Показано, что протеолиз ПТГрП под действием PSA устраняет индуцированную ПТГрП активность цАМФ в клетках MC3T3E1, что представляет
собой потенциальный простат-специфический механизм регуляции активности ПТГрП. Также имеются данные, свидетельствующие о том, что ПТГрП (1–23) стимулирует образование новой кости черепа (Chirgwin J.M. et al., 2004). В дополнение к PSA ПТГрП (1–23) может также генерироваться неприлизином, ферментом класса матриксных металлопротеиназ (MMP), которые зависят от присутствия иона металла в их активном центре для катализа протеолиза (Ruchon A.F. et al., 2000). ПТГрП был идентифицирован как субстрат MMP-2, -3, -7, -9 и -13, которые преимущественно генерируют фрагменты ПТГрП (1–17), ПТГрП (18–26) и ПТГрП (27–36) (Frieling J.S. et al., 2017), Неприлизин также может генерировать ПТГрП (1–26), предполагая, что матриксные металлопротеиназы могут быть важными факторами, участвующими в посттрансляционной регуляции активности ПТГрП, и в то же время ставит вопросы относительно временной динамики, приводящей к выработке
ПТГрП (1–23) или ПТГрП (1–26). Временная последовательность этих протеолитических каскадов также может быть важна для облегчения посттрансляционной обработки ПТГрП.
ПТГрП содержит лидерную последовательность из 36 аминокислотных остатков (сигнальный пептид от –36 до –1), используемую для внутриклеточного транспорта и секреции (Cingolani G. et al., 2002). Лидерная последовательность удаляется, когда формирующийся протеин попадает в эндоплазматический ретикулум (Liu B. et al., 1995). После удаления лидерной последовательности полученный продукт считается «про-ПТГрП» и подлежит дальнейшей посттрансляционной модификации и активации протеолитическим расщеплением. Показано, что удаление лидерной последовательности и протеолиз в локусе Arg37 ферментами, такими как фурин или протеиназа протиолового гормона, генерируют ПТГрП (1–36) (Soifer N.E. et al., 1992; Hook V.Y. et al., 2001). Полагают, что дополнительные функции для продуктов трансформации ПТГрП за пределами тех, которые известны для ПТГрП (1–36) в костной или других тканях, еще предстоит определить. Хотя точные сайты расщепления и ответственные за это протеазы не полностью выяснены, восприимчивость ПТГрП к протеолизу может служить механизмом контроля продолжительности воздействия и изменения активности ПТГрП в сторону большего количества паракринных и аутокринных ролей, в отличие от канонических эндокринных ролей, приписываемых ПТГ. Альтернативно, этот процессинг может быть ответственным за генерацию совершенно иных пептидных продуктов с новыми активностями или выполнять роль негативного регулирования или ослабления активностей ПТГрП (Frieling J.S., Lynch C.C., 2019) (рис. 2).

Рис. 2. Возможная схема препаратгормон-родственного протеина и протеолитического процессинга ПТГрП на 3 биологически активных пептида. Сигнальный пептид включает последовательность препро (–36–1). N-терминальный домен ПТГрП (1–34), взаимодействующий с рецептором PTH1R. Срединная область ПТГрП (Midregion), отвечающая за плацентарной транспорт кальция, содержит сигнальный пептид ядерной локализации
(NLS) (67–86). C-терминальный домен содержит последовательность
(107–111) (osteostatin)
Из этих белковых структур в результате посттрансляционного процессинга формируются зрелые секреторные формы биологически активных пептидов, каждый из которых имеет свою собственную функциональную роль в организме участвуя в инициации и регуляции различных физиологических, патофизиологических и патобиохимических эффектов (Orloff J.J. et al., 1994; Strewler G.J. et al., 1987; Zheng M.H. et al., 1994; Luparello C., 2010). К зрелым секреторным формам пептидов относят: N-концевой домен (1–34 или 1–36), срединный фрагмент (midregion) (38-94 или 67–86) и С-концевой домен (107–139 или 102–141) (Strewler G.J., 2000; Wysolmerski J.J., 2012) Различные изоформы молекул ПТГрП содержат различающиеся С-концевые терминалы. Биологические роли, если таковые имеются, частей ПТГ и ПТГрП, которые проходят на С-конце, неизвестны. Эти области двух лигандов имеют небольшую или нулевую гомологию аминокислотной последовательности, и они, по-видимому, не вносят существенного вклада во взаимодействия с PTH1R. Это демонстрируется обнаружением того факта, что химически синтезированные полипептиды ПТГ (1–84) и ПТГрП (1–141) каждый проявляют аффинность связывания и сигнальные способности на PTH1R, которые неотличимы от таковых у аналогичного N-концевого пептидного фрагмента (Dong S. et al., 2012; Li J. et al., 2012). Тем не менее остается возможным, что С-концевые области лигандов модулируют, прямо или косвенно, взаимодействие с PTH1R в тканях-мишенях in vivo. Интересно также учитывать, что различия в C-концевых областях двух лигандов в некоторой степени объясняют различные способы, которыми эти два лиганда выполняют свои биологические функции, то есть эндокринную модальность, с помощью которой ПТГ контролирует Ca и гомеостаз Pi по сравнению с паракринной модальностью, с помощью которой ПТГрП контролирует программы дифференцировки клеток., Существует вероятность того, что С-концевые домены ПТГ и ПТГрП могут функционировать автономно и независимо от PTH1R.
N-концевые терминалы изоформ имеют частично гомологичные с ПТГ аминокислотные последовательности, что позволяет им связываться с рецептором ПТГ первого типа (PTH1R) (Campos R.V. et al., 1995). Представлена структура биологически активного NH2-терминального домена ПТГрП человека (1–34), определенная с помощью двухмерной протонной магнитно-резонансной спектроскопии. (Weidler M. et al., 1999). Улучшенная стратегия расчета структуры показала наличие двух спиралей His-5-Leu-8 и Gln-16-Leu-27, связанных гибким линкером. Структура ПТГрП (1–34) и структура человеческого паратиреоидного гормона (1–34) очень похожи, за исключением четко определенного поворота, His-14-Ser-17, присутствующего в паратиреоидном гормоне. Таким образом, сходство аффинности связывания паратиреоидного гормона и ПТГрП с их общим рецептором может основываться на их структурном сходстве. Семейство биологически активных пептидов генерируется путем альтернативного сплайсинга первичного транскрипта, а также за счет использования альтернативных посттрансляционных сайтов расщепления белковых молекул путем протеолитического процессинга. Посттрансляционная модификация путем протеолиза исходных изоформ ПТГрП генерирует образование пептидов, которые функционируют в качестве паракринных эффекторов, имеют короткий период полураспада, а также многочисленные виды биологической активности (Orloff J.J. et al., 1994; Sellers R.S. et al., 2004; Philbrick W.M. et al., 1996). N-концевая область ПТГрП (1–34) содержит аминокислотную последовательность: –H–Ala–Val–Ser–Glu–His–Gln–LeuLeu–His–Asp–Lys–Gly–Lys–Ser–Ile–Gln–Asp–Leu–Arg–Arg–Arg–Phe–Phe–Leu–His–HisLeu–Ile–Ala–Glu–Ile–His–Thr–Ala–OH. Домен ПТГрП (1–34) способен активировать общий для ПТГ и ПТГрП рецептор PTH1R (Strewler G.J., 2000; Mannstadt M. et al., 1999).
Особым биологическим свойством ПТГрП является его локализация в клетке. Пептид может синтезироваться в аппарате Гольджи и локализоваться в цитоплазме либо секретироваться в околоклеточное пространство. Помимо того, что ПТГрП секретируется клетками, он также может действовать внутри клеток через интракрикринный путь. ПТГрП генерируется в таких клетках, но не секретируется из нее, а транслоцируется в ядро клетки, где оказывает во многом неясное влияние на ядерные функции (Lam M.H. et al., 2000). Транскрипция гена ПТГрП может быть инициирована с альтернативного нижестоящего стартового сайта, который обходит сигнальный пептид и позволяет ПТГрП оставаться в клетке (Jans D.A. et al., 2003). Альтернативно, ПТГрП также может связываться со своим рецептором на поверхности клетки и транспортироваться обратно в клетку после интернализации (Fiaschi-Taesch N.M., Stewart A.F., 2003). ПТГрП содержит классическую последовательность ядерной локализации (NLS), расположенную между аминокислотами 84–93, что позволяет ему регулируемым образом перемещаться из цитоплазмы в ядро и из него. В культивируемых клетках ядерный ПТГрП влияет на пролиферацию клеток и/или апоптоз и часто, по-видимому, противодействует эффектам секретируемого ПТГрП (Boras-Granic K. et al., 2014). Исследование последствий потери NLS ПТГрП in vivo провели с использованием животных, у которых эндогенный мышиный ген ПТГрП заменили укороченными версиями, кодирующими формы мутантного ПТГрП (ПТГрП (1–66) или ПТГрП(1–84), в которых отсутствуют NLS и С-концевой домен (Miao D. et al., 2008; Toribio R.E. et al., 2010). В обоих случаях исключение ПТГрП из ядра приводило к нарушению роста, преждевременному остеопорозу, снижению гемопоэза, изменению энергетического обмена и, в конечном итоге, преждевременной смерти в возрасте около 2 недель. Произошло уменьшение пролиферации хондроцитов, остеобластов, нейронов и клеток костного мозга, а также увеличение апоптоза или старения в этих местах, а также в тимусе и селезенке. Потеря NLS ПТГрП была связана с повышенной экспрессией маркеров старения, таких как p21 и p16INK4a. (Miao D., et al., 2008). Этот фенотип предполагает, что ядерный NLS ПТГрП может широко участвовать в регуляции пролиферации и выживания клеток, а также в поддержании стволовых клеток/клеток-предшественников.
Понимание того, как этот белок транспортируется через ядерную оболочку и как регулируются процессы импорта, является важным аспектом понимания функции клеток. Структурная биология сыграла ключевую роль в понимании молекулярных событий во время транспортных процессов и их регулирования, включая распознавание сигналов ядерного нацеливания соответствующими рецепторами. Структурную основу основных путей ядерного импорта и молекулярную основу их регулированияобеспечивают факторы транспорта, являющиеся членами семейства β-кариоферина, которые могут напрямую связывать перемещаемую молекулу (например, импортин-β, транспортин-1, транспортин-3, импортин-13) или через переходные белки (например, импортин-α, симпортин-1), а также несвязанные транспортные факторы, такие как Hikeshi, участвующие в транспортировке белков теплового шока, и NTF2, участвующие в транспортировке RanGDP (Christie M. et al., 2015). Кроме того некоторые клетки используют альтернативные трансляционные инициирующие кодоны для образования белковых молекул предназначенных для ядерной локализации. N-конец молекулы ПТГрП обеспечивает паракринные сигнальные свойства этого белка, тогда как остальная часть молекулы обладает другими функциями, и в том числе связанными с интракринной сигнальной ролью в ядре-нуклеолусе при регуляции апоптоза и пролиферации клеток. Ядерный импорт белков, содержащих классический сигнал ядерной локализации (NLS), включая ПТГрП, импортируются в ядро путем прямого взаимодействия с импортином β. Показано, что внутриклеточно продуцируемый ПТГрП способен перемещаться в зависимости от клеточного цикла и сигнала между ядром и цитоплазмой посредством действия отдельных внутриклеточных транспортных молекул импортин β1 и экспортин 1, опосредующих ядерный импорт и экспорт ПТГрП, соответственно. Вместе пути импорта и экспорта представляют собой интегрированную систему для субклеточной локализации ПТГрП (Lam M.H. et al., 1999) (рис. 3).
Ядерно-нуклеолярный импорт ПТГрП зависит от целостности микротрубочек, а перенос в ядро, частично опосредованный действием импортина β1, осуществляется вдоль микротрубочек. Было показано, что ПТГрП может связываться с РНК. Это означает, что ПТГрП способен выполнять роль нуклеоцитоплазматического челнока и может участвовать в регуляции синтеза и переноса РНК в ядре-нуклеолусе. ПТГрП индуцирует интракринно свое влияние на различные процессы посредством пептида ядерной локализации (NLS), взаимодействующего с рецептором ПТГрП первого типа (PTH1R), также локализованным в ядре. Эти данные свидетельствуют о ролях системы ПТГ/ПТГрП-PTH1R в регулировании событий в ядре клетки либо на нуклеоскелетоне, либо непосредственно на уровне экспрессии гена (Clemens T.L. et al., 2001; Goomer R.S. et al., 2000; Watson P.H. et al., 2000).
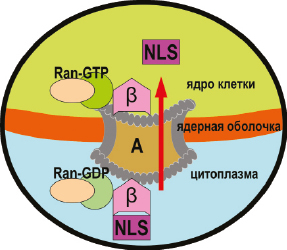
Рис. 3. Механизм ядерного импорта ПТГрП включает сигнальный пептид ядерной локализации (NLS), образующую комплекс с импортином ?
и Ran-нуклеотидным комплексом Ran-GDP, состоящим из фермента ГТФаза и нуклеотида гуанозиндифосфата. Ran-GDP участвует в переносе других белков из цитозоля в ядро в эукариотических клетках. Этот комплекс транспортируется через ядерный поровый комплекс (А) в ядро