
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
5.2.2. Роль паратгормон-родственного протеина в физиологической регуляции формирования костной ткани
В постнатальном периоде ПТГрП играет важную роль в физиологической регуляции формирования костной ткани (Amizuka N. et al., 1996; Miao D. et al., 2002), способствуя росту и выживанию остеобластов и участвуя в остеокластогенезе (Fenton A.J. et al., 1991; Martin T.J. 2005), а также является важным элементом сложной системы минерализации костей (Boileau G. et al., 2001). Эндокринные механизмы физиологической регуляции метаболизма костной ткани при участии ПТГрП имеют место, когда продуцируемый в молочной железе белок поступает в кровоток (Grill V. et al., 1992) и в период эмбрионального развития плода, когда он регулирует трансплацентарный транспорт кальция (Care A.D. et al., 1990; Grill V. et al., 1992; Wu T.L. et al., 1996; Kovacs C.S. et al., 1996; Simmonds C.S., Kovacs C.S., 2010). Значительно больше известно о многочисленных паракринных эффектах ПТГрП в различных тканях. Как паракринный фактор, пептид регулирует рост и развитие многих тканей и, в первую очередь, скелета и молочных желез (McCauley L.K., Martin T.J., 2012). ПТГрП является также важным физиологическим регулятором массы костной ткани взрослых организмов (Bisello A. et al., 2004). Функциональная роль ядерной локализации сигнала ПТГрП в клетках остеобластов была изучена в экспериментах с использованием трансфицированных мышиных остеобластных MC3T3-E1 клеток, в которых оценивали внутриклеточный транспорт, пролиферацию и жизнеспособность, а также дифференцировку (Garcia-Martin A. et al., 2014). Полученные результаты показали сложность механизмов действия ПТГрП в остеобластах и позволили предположить, что действие этого протеина на их рост и функции паракринным, аутокринным и интракринным путями реализуется через несколько доменов последовательно при участии сигнального пептида N-концевого домена ПТГрП, сигнала ядерной локализации (NLS) содержащего последовательность ПТГрП (88–107) и рецептора PTH1R. Цитоплазма и/или ядерные эффекторы выступают в качестве преобразователей модулирующего действий ПТГрП через эти различные пути на рост, дифференцировку и функции остеобластов. Было показано, что у нокаутных мышей, экспрессирующих усеченные формы ПТГрП с отсутствием срединного домена или С-концевой области происходит преждевременное развитие остеопороза (Toribio R.E. et al., 2010), что свидетельствует о значительной роли этих фрагментов ПТГрП в развитии и метаболизме костной ткани. ПТГрП стимулирует остеобластную функцию через N- и C-концевые домены. Остеогенное действие С-концевого домена, по-видимому, зависит, по крайней мере частично, от его взаимодействия с системой сосудистого эндотелиального фактора роста (VEGF). Исследование предполагаемого механизма этого взаимодействия в остеобластах показало, что как ПТГрП (107–139), так и более короткий фрагмент ПТГрП (107–111), известный как остеостатин, способствовали появлению рецептора VEGF (VEGFR) 2 в клетках мышиных остеобластов линии MC3T3-E1. Более того, остеостатин значительно увеличивал фосфорилирование VEGFR2. Кроме того, остеостатин индуцировал фосфорилирование Src-киназы и внеклеточной сигнально-регулируемой киназы (ERK), что наблюдалось при активации VEGFR2 в этих остеобластических клетках. В совокупности эти данные показывают, что фрагмент C-терминального домена ПТГрП остеостатин фосфорилирует VEGFR2 через Src активацию, которая представляет собой механизм модуляции функции остеобластов (Garcia-Martin A. et al., 2013). Получены данные о том, что домен ПТГрП (107–139) повышает выживаемость остеобластов человека путем активации рецептора-2 фактора роста эндотелия сосудов (Alonso V. et al., 2008). Прединкубация с ПТГрП (107–139) ингибирует дексаметазон- или этопозид-индуцированную гибель остеобластических MG-63 клеток человека и человеческих остеобластподобных- клеток из губчатой кости. Этот эффект, был отменен ингибированием рецептора VEGF (VEGFR-2). Под влиянием ПТГрП (107–139), но не ПТГрП (1–36), увеличилось VEGFR-2 тирозин-фосфорилирование в MG-63 клетках. В соответствии с его влиянием на активацию VEGFR-2 ПТГрП (107–139) быстро индуцирует внеклеточную регулируемую киназу (ERK). Трансфекция с доминантно-негативной Runx2 конструкции отменяла действие ПТГрП (107–139) на выживаемость остеобластов. Полученные результаты показали, что взаимодействие ПТГрП (107–139) с VEGFR-2 способствует выживанию остеобластов клеток человека с помощью механизма с участием активации RUNX2. Фрагмент С-концевого домена ПТГрП (107–111) ингибирует костную резорбцию остеокластами (Fenton A.J. et al., 1991) и этот эффект связан с активацией протеинкиназы С. C-терминальный домен ПТГрП (107–139) и его фрагмент ПТГрП (107–111) ингибируют пролиферацию и дифференцировку клеток, подобных остеобластам человека. В дополнение к антимитогенному действию, ПТГрП (107–139) и ПТГрП (107–111) ингибировали активность базальной щелочной фосфатазы и 1,25-дигидроксивитамин D3 (1,25 (OH) 2D3)-стимулированной щелочной фосфатазы. Оба пептдных фрагмента уменьшали секрецию проколлагена I типа, но секреция остеобластподобными клетками остеокальцина под воздействием C-концевых фрагментов ПТГрП не изменялась (Martinez M.E. et al., 1997). Эти результаты показывают, что ПТГр может действовать как местный регулятор формирования костей. Данные экспериментов на трансгенных мышах показывают, что ПТГрП локально в костной ткани имеет важное значение для нормального костного ремоделирования. В то время как основной физиологической функцией ПТГ является гормональная регуляция обмена кальция, локально продуцируемый ПТГрП является важным постнатальным физиологическим регулятором ремоделирования кости (Martin T.J., 2016). Значение ПТГрП для развития скелета было убедительно продемонстрировано в экспериментах на мышах с нокаутом гена, контролирующего экспрессию этого протеина. У мышей с гомозиготной инактивацией гена ПТГрП выявлялась выраженная хондродисплазия, отражающая дефект развития в пролиферации и дифференцировки хряща. Такие мыши имели множественные дефекты развития скелета (Amizuka N. et al., 1994) и погибали сразу после рождения от дыхательной недостаточности, связанной с дефектами формирования грудной клетки (Karaplis A.C. et al., 1994; Hirai T. et al., 2011). У трансгенных мышей с торможением образования ПТГрП отмечено увеличение апоптоза остеобластов и снижение образования остеокластов, что свидетельствует о существенной роли пептида в формировании костной ткани (Miao D. et al., 2005). Человеческие эмбрионы с дефектными рецепторами PTH1R (Blomstrand – хондроостеодистрофия) умирают в утробе матери из-за множественных скелетных аномалий. У людей с метафизарной хондродисплазией Янсена проявляются нарушения роста (врожденная карликовость с деформацией конечностей, недоразвитием костей лица, брахицефалией, задержкой оссификации эпифизов), вызванные мутациями в гене, кодирующем рецептор PTH1R, которые делают рецептор активным даже в отсутствие лиганда, что приводит к задержке дифференциации хондроцитов (Nissenson R.A., 1998) (рис. 12).
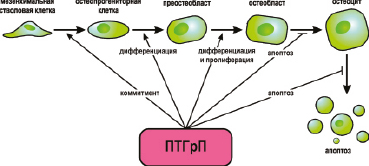
Рис. 12. Роль паратгормн-родственного протеина в костном ремоделировании. ПТГрП контролирует остеобластную направленность дифференцировки мезенхимальных стволовых клеток. ПТГрП также контролирует пролиферацию, апоптоз и минерализацию остеобластов/остеоцитов.
Кроме того, ПТГрП способствует остеокластогенезу через остеобласты, что, в свою очередь, влияет на остеобластогенез. Таким образом ПТГрП: регулирует мезенхимную приверженность, способствует дифференцировке остеобластов, регулирует пролиферацию остеобластов, подавляет минерализацию остеобластов, ингибирует апоптоз остеобластов и способствует дифференцировке остеокластов через остеобласты
ПТГрП может влиять на костный метаболизм, модулируя действия трансформирующего фактора роста (ТGF- β) посредством уменьшения скорости синтеза остеокальцина, возможно, на уровне транскрипции, а также участвует в стимуляции дифференцировки клеток костной ткани (Weiss S. et al., 2010). Его влияние на костную ткань опосредуется через систему цитокинов и, в том числе, интерлейкина-6 и фактора некроза опухоли (ФНО-альфа), а также систему остеопрогерина/RANKL. В естественных условиях ПТГрП стимулирует экспрессию остеобластами интерлейкина-6. ПТГрП оказывает непосредственное влияние на цикл остеобластных клеток, которое зависит от стадии их развития. ПТГрП посредством уменьшения экспрессии циклина D1 индуцирует остановку клеточного цикла остеобластов. Эти данные, свидетельствуют, что ПТГрП влияет на продолжительность жизни и активность остеобластов в костной ткани (Datta N.S. et al., 2007). Остеобласты не единственные клетки, продуцирующие RANKL для ремоделирования костной ткани. Две независимые группы исследовали роль остеоцитов в естественных условиях и обнаружили, что они играют важную роль в ремоделировании костной ткани являясь основным источником RANKL для остеокластогенеза (Nakashima T. et al., 2011; Xiong J. et al., 2011). Эти исследования поставили под сомнение догму костной биологии, постулирующую, что остеобласты являются ключевыми клетками, которые модулируют костное ремоделирование. Эффекты ПТГрП ограничены не только прямым воздействием на такие костные клетки, как остеобласты и остеоциты. Посредством активации этих клеток, ПТГрП индуцирует продукцию множества факторов роста и цитокинов, а также модулирует состояние других клеточных компонентов костного матрикса, таких как стромальные клетки и клетки иммунной системы. Исследования показали, что сопутствующая экспрессия воспалительных цитокинов, таких как TNF, IL-1 и IL-6, увеличивает активность резорбции кости (De La Mata J. et al., 1995; Sato K. et al., 1989; Uy H.L. et al., 1997). Глюкокортикоид-индуцированное угнетение экспрессии ПТГрП и рецептора PTH1R в мезенхимальных стволовых клетках человека может быть одним из механизмов стероидиндуцированной потери костной массы (Ahlstrom M. et al., 2009). Изучение остеотропных эффектов ПТГрП (1–36) или ПТГрП (107–139) проводили в опытах с ингибированием канонического сигнального пути Wnt воздействием высоких концентраций D-глюкозы в культуре остеобластических клеток мыши MC3T3-E1 (Lopez-Herradon, A. et al., 2013). Полученные данные демонстрируют, что высокая концентрация глюкозы может влиять на различные компоненты канонического пути Wnt. Деградация β-катенина является ключевым событием, приводящим к ингибированию передачи сигналов Wnt/ β-catenin в остеобластических клетках мыши. Оба исследованных пептида ПТГрП смогли противодействовать этому эффекту. Результаты экспериментов in vitro позволяют лучше понимать основные механизмы, посредством которых ПТГрП может оказывать остеогенный эффект.