
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.2. Изменение вязкости рассолов с ростом минерализации
Исследования концентрированных растворов солей, образующих кристаллогидраты, с помощью криоскопических измерений, измерения вязкости, электропроводности и спектров поглощения показывают, что в таких растворах часть молекул воды включается в образование сложных гидратов и не присутствует в растворе как растворитель.
На графике (рис. 3) представлена зависимость динамической вязкости исследуемых рассолов от их минерализации. В области малых концентраций изменение вязкости происходит незначительно, так как здесь еще существует первичная структура воды и самостоятельная структура гидратных сфер ионов. С ростом минерализации соотношение меняется и преобладающей становится структура гидратированных ионов, что на ГПГ выражается в существовании физико-химической системы , где все ионы однослойно гидратированы и сближены на расстояния, составляющие в среднем 0,467±0,08 нм [38], а структура воды, как свободная фаза исчезает.
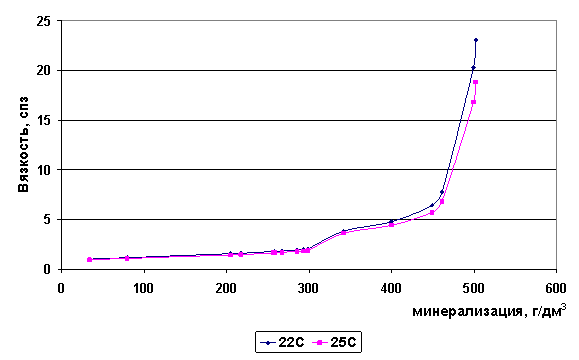
Рис. 3. Зависимость вязкости рассолов от минерализации
Можно отметить две области минерализаций, после которых значение вязкости начинает резко возрастать. Первая область характерна для рассолов с минерализацией 320-340 г/дм3. Во второй области (450-550 г/дм3) происходит резкое, скачкообразное повышение вязкости. Следовательно, в рассолах данных диапазонов минерализаций следует ожидать максимумы электропроводности. В соответственных областях минерализаций структура раствора переходит из области, где существует структура воды, в область, в которой ближняя упорядоченность раствора соответствует структуре кристаллогидрата (граница полной гидратации - ГПГ).
За ГПГ, на фоне нарастающего дефицита воды (см. рис. 3), начинается, по мнению А.В.Кудельского, координационная дегидратация, состоящая в перераспределении молекул воды гидратных оболочек в пользу наиболее гидрофильных ионов, что и проявляется в резком изменении свойств рассолов.
Знание форм нахождения ионов в рассолах, определенное на основании гидрохимических расчетов и сравнение их процентного соотношения и степени гидрофильности (как простых ионов, так и комплексных форм) позволяет предсказать степень их гидрофильности, а соответственно, способность выделяться в различных технологических процессах. В связи с этим и подход к изучению влияния структуры растворителя, а именно воды, должен быть различен для рассолов различной минерализации. За ГПГ первоначальной структуры воды не существует, и все особенности системы определяются характеристиками составляющих ее ионов, их гидратированностью и т.д. До ГПГ значительна роль изменения структуры воды, в том числе под действием этих же самых ионов, которые, как известно, могут усиливать либо ослаблять ее структуру. Таким образом, напрашивается вывод, что для рассолов различного состава (с преобладанием иона натрия, кальция либо магния) точка ГПГ должны быть различна. Однако ее значение зависит не от абсолютного значения концентраций этих компонентов, а именно от их соотношения, что и выражается в изменении результирующих показателей, таких как, например, вязкость, адекватно отражающих структурно-химические особенности рассолов и структурные перестроения в жидкости.
Это подтверждается сравнением концентрационных зависимостей вязкости индивидуальных растворов солей. Концентрации растворов соответствуют содержанию соответствующих солей в природных рассолах Сибирской платформы. На графиках (рис. 4-6) приведены зависимости динамической вязкости от концентрации растворов индивидуальных солей - хлоридов лития, натрия и калия. Графики построены на основании литературных и экспериментальных данных [70, 71], а также на основании расчётов по формулам. Формулы для расчёта вязкости -
Формула 1 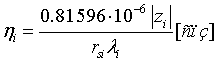
Формула 2 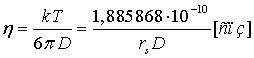
Формула 3 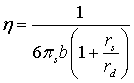
где 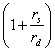 - параметр экранирования, учитывающий колебательный характер; zi - радиус (см) и заряд иона; rs и rd - радиус сольватированного иона и дебаевский радиус экранирования; Эквивалентная ионная электропроводность λ; абсолютная подвижность - b; rs - радиус сольватированного иона; D - коэффициент диффузии.
- параметр экранирования, учитывающий колебательный характер; zi - радиус (см) и заряд иона; rs и rd - радиус сольватированного иона и дебаевский радиус экранирования; Эквивалентная ионная электропроводность λ; абсолютная подвижность - b; rs - радиус сольватированного иона; D - коэффициент диффузии.
Для растворов индивидуальных солей - хлоридов лития, натрия максимумы электропроводности следует ожидать соответственно при концентрациях 212 и 117 мг/дм3, а для хлорида калия возможно появление двух максимумов электропроводности - и 45 и 150 мг/дм3.
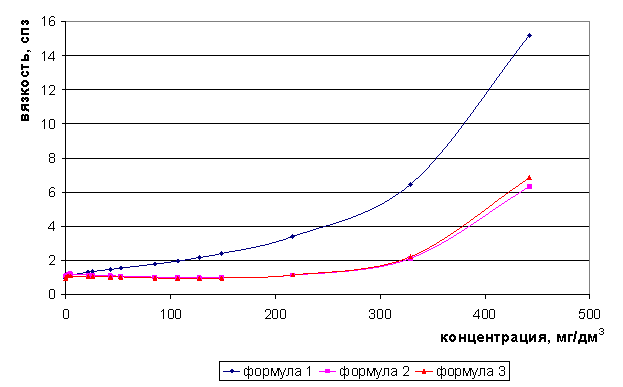
Рис. 4. Зависимость вязкости раствора LiCl от концентрации
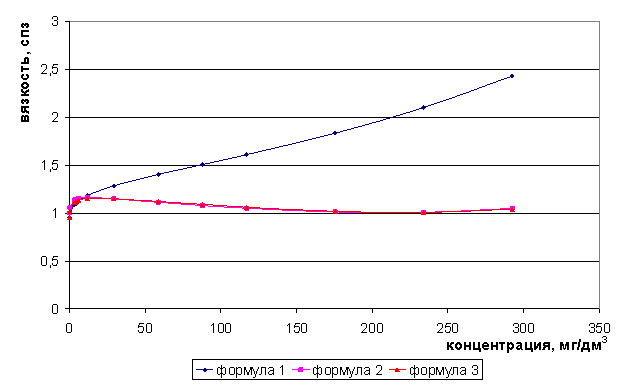
Рис. 5. Зависимость вязкости раствора NaCl от концентрации
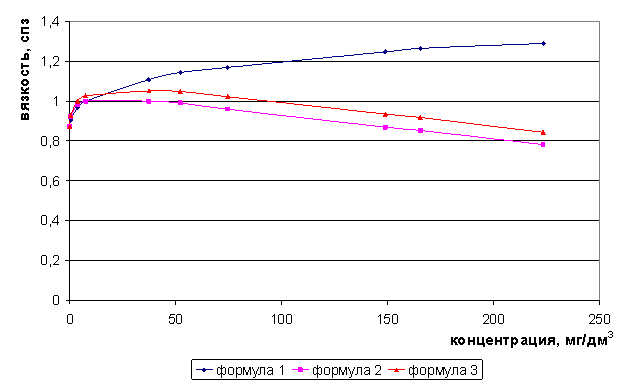
Рис. 6. Зависимость вязкости раствора KCl от концентрации
