
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.3. Электропроводность высококонцентрированных растворов и рассолов
Данные по электропроводности водных растворов солей представляют большой интерес в связи с вопросом о структурных изменениях в растворах электролитов. В системе соль - вода изотермы электропроводности, относящиеся к не слишком высоким температурам, при некоторой концентрации проходят через максимум. Если входящая в систему соль образует кристаллогидраты [69], то на изотермах для температур, удаленных от температуры плавления эвтектики не более, чем на 75-100°, максимум электропроводности наблюдается при концентрации, которая в пределах 1-2 мол.% совпадает с составом эвтектики. Если соль не образует кристаллогидратов, то состав, соответствующий максимуму электропроводности, не совпадает с составом эвтектики, а находится преимущественно в области более высоких концентраций. Существование максимума электропроводности обусловлено тем, что при некоторой концентрации соли начинается резкое возрастание вязкости раствора, и подвижность ионов убывает.
Нами определена удельная электропроводность в рассолах различных минерализаций. Из графиков зависимости удельной электропроводности рассолов от общей минерализации Собщ (рис. 7) видно, что электропроводность увеличивается с ростом минерализации до значения Собщ=400 г/дм3, после чего начинает падать. Максимум при этой минерализации согласуется с резким увеличением вязкости для рассолов с минерализацией 400 г/дм3.
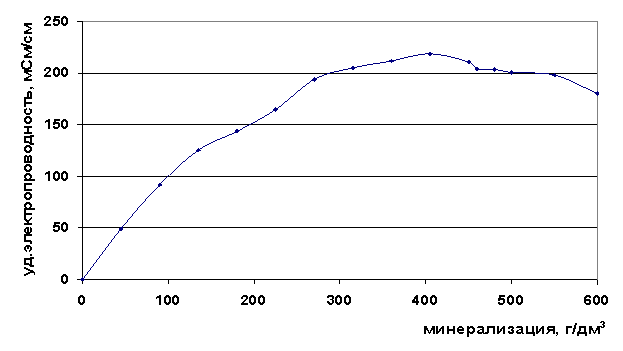
Рис. 7. Зависимость удельной электропроводности от минерализации рассола
Максимум электропроводности соответствует структурному переходу в растворе. При не слишком высоких температурах этот переход осуществляется через область наибольшей неоднородности структуры раствора. Максимум электропроводности соответствует квазиэвтектической, наиболее «испорченной» структуре. Смещение максимума электропроводности системы соль - вода, в тех случаях, когда соль не образует кристаллогидратов, в сторону соли согласуется с данными о значительном развитии флуктуаций в насыщенных растворах КСl. Мы построили зависимость удельной электропроводности от концентрации растворов индивидуальных солей при температуре 22°С по литературным данным (рис. 8) [71, 72]. Максимальное значение электропроводность имеет в достаточно узком концентрационном диапазоне до 0,2 моль/дм3 для хлоридов натрия, калия и лития, а при увеличении концентрации значение электропроводности не растёт, а снижается.
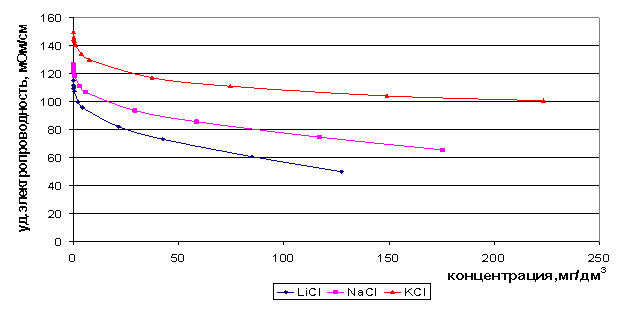
Рис. 8. Зависимость удельной электропроводности растворов от концентрации
При увеличении концентрации можно было бы ожидать, что удельная электропроводность будет возрастать, так как увеличивается число ионов, переносящих ток в растворе. По результатам наших исследований удельной электропроводности на кондуктометре «Эксперт» эта зависимость не соблюдается также как и по литературным данным, но лишь в определённых концентрациях. При достижении определенного максимального значения удельная электропроводность раствора LiCl начинает уменьшаться - максимум электропроводности в индивидуальном растворе составляет 8,5 г/дм3 (рис. 9). Такой характер изменения электропроводности мы объясняем тем, что при дальнейшем росте концентрации электролита уменьшается расстояние между ионами, следовательно, понижается подвижность из-за усиления межионного взаимодействия. Для сильных электролитов усиливаются релаксационный и электрофоретический эффекты торможения [73].
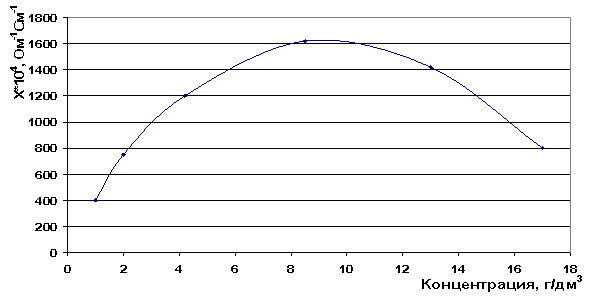
Рис. 9. Зависимость электропроводности от концентрации раствора LiCl
Для раствора MgCl2*6H2O наблюдается два максимума электропроводности - при концентрациях 3,2 г/дм3 и 9,5 г/дм3 (рис. 10).
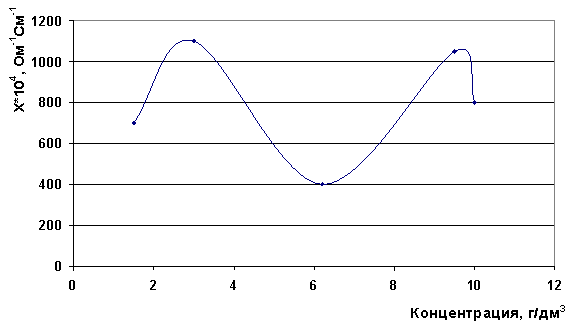
Рис. 10. Зависимость электропроводности от концентрации раствора MgCl2*6H2O
Полученные результаты удельной электропроводности для хлорида стронция полностью согласуются с положениями теории электропроводности -удельная электропроводность увеличивается с увеличением концентрации ионов в растворе (рис. 11).
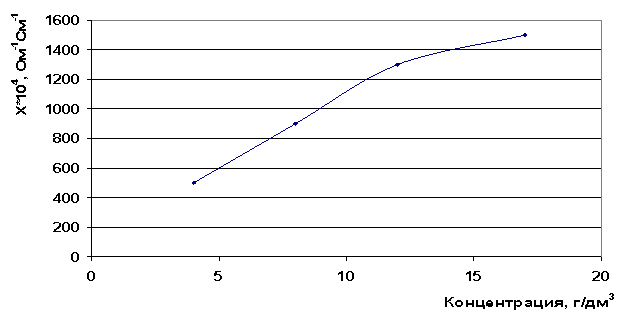
Рис. 11. Зависимость электропроводности от концентрации раствора SrCl2
Кинетические свойства (электропроводность, диффузия, вязкость) определяются преимущественно энергией многочастотных взаимодействий ионов в диэлектрической среде.
