
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
6.3.4. Изучение влияния минерализации на вовлечение ионов в ледяную и жидкую фазу
Количество вовлечённых в лёд веществ в большей степени зависит от скорости льдообразования. Концентрация во льду ионов Cl-, SO42-, HCO3- увеличивается с ростом их концентрации. Зависимость содержания ионов во льду от их содержания в исходном растворе носит линейный характер в ограниченных пределах. Для Cl- и SO42- это концентрация 5-6 г/дм3, для HCO3- - 500 мг/дм3. При концентрации хлорид- и сульфат-ионов в исходном растворе, равной 6 г/дм3 и выше, вовлечение их в лёд начинает уменьшаться, а при концентрации выше 500 мг/дм3 возрастать [79].
Мы исследовали процесс замораживания рассолов двух различных генетических типов: хлоридно-натриево-калиевого и хлоридно-кальциево-магниевого. Оказалось, что степень вовлечения в ледяную фазу для различных компонентов рассола разная. Из диаграмм для двух элементов -кальция и магния (рис. 45-46) - видно, что распределение этих элементов между ледяной и жидкой фазами становится ощутимым при повышенных минерализациях замораживаемого раствора, в нашем случае - для рассола с Собщ=200 г/дм3. Установлено, что для солёных вод с небольшой общей минерализацией (до 16 г/дм3) элементы - кальций и магний - одинаково вовлекаются как в лёд, так и в незамёрзшую рассольную фазу. 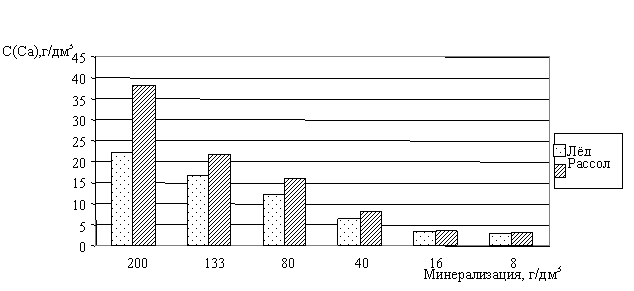
Рис. 45. Зависимость вовлечения ионов кальция в ледяную и жидкую фазы от исходной минерализации замораживаемого рассола
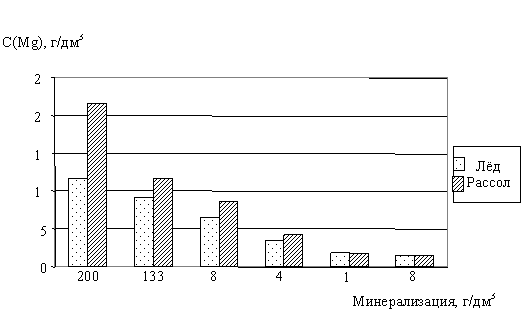
Рис. 46. Зависимость вовлечения ионов магния в ледяную и жидкую фазы от исходной минерализации замораживаемого рассола
При льдообразовании в природных условиях, помимо ледовой фазы, возможна кристаллизация других фаз, главным образом, - солей, образование коллоидных осадков (криокоагулянтов). В упрощённом виде соосаждение со льдом включает в себя адсорбцию, окклюзию, образование твёрдых растворов (изоморфных соединений). В обоих случаях играют роль электрические явления на границе вода-лёд [75,76].
Катионы щелочных и щелочноземельных металлов взаимодействуют с поверхностью льда электростатически (физическая адсорбция), хемосорбция установлена для анионов. Величина потенциала ионизации таких ионов лежит в пределах 9-10 эВ и близка к 9,6 эВ - потенциалу ионизации молекул воды. Вероятно, поэтому из анионов наиболее избирательно будут сорбироваться Cl- - ион, потенциал ионизации которого 9,15 эВ, F-, Br-, J- - ионы (10,0; 9,1; 8,9 эВ - соответственно их потенциалы ионизации). Адсорбция льдом катионов связана с их влиянием на структуру воды. Наименьшим влиянием, а, следовательно, наименьшей способностью к включению в лёд обладают ионы, у которых величина гидратационной постоянной близка к нулю. Поэтому из щелочных ионов лучше всего должен сорбироваться калий. Ионы щелочноземельных металлов обладают очень слабым адсорбционным взаимодействием со льдом.
Селективное внедрение ионов в кристаллы льда обусловлено адсорбционной окклюзией. На этот процесс большое влияние оказывают все ионы раствора. Тот или иной ион в присутствии одного типа «интерферирующего» иона может легко включаться в лёд, а при другом, находящемся даже в ничтожных количествах, - внедряется в него с большим трудом. В этом причина плохой воспроизводимости процесса в экспериментах.
Механизм окклюзии связан с возможностью адсорбции льдом веществ из замерзающего раствора и определяется блокированием адсорбата. Зародышевые кристаллы постепенно растут, их поверхность обновляется за счёт отложения всё новых и новых слоёв льда. Эта обновляющаяся поверхность всё время адсорбирует ионы из раствора. В процессе роста кристаллов примеси вытесняются соединениями, входящими в состав кристаллической решётки льда. Однако, такое вытеснение происходит недостаточно полно; та или иная часть адсорбированных ионов оказывается отделённой от раствора вновь отложившимися слоями воды и остаётся внутри кристаллической решётки.
Калий вовлекается в лёд из разбавленных растворов интенсивнее натрия, т.к. он в результате повышения степени гидратации препятствует образованию льдоподобных структур, в отличие от натрия. На соотношение Na+/K+ во льду в огромной степени влияет разность потенциалов на границе лёд-вода, которая, в свою очередь, формируется под влиянием подвижности ионов и их ассоциатов.
Замерзание воды на границе раздела фаз вызывает электрические потенциалы и разрядные токи. Их появление связывают с избирательным вовлечением в лёд какого-либо из ионов растворённых веществ. Контактная разность потенциалов между дистиллированной водой и льдом равна 0,1-0,2 В. В разбавленных растворах электролитов величина электрического потенциала иногда достигает 200 В, а разрядного тока - 2 мА. Носителями зарядов во льду являются протон и заряженные радикалы (Н3О) и (ОН), причём большое время их жизни (намного продолжительнее, чем в жидкой фазе) обусловлено кулоновским отталкиванием радикалов во льду.
