
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Практикум по спектроскопии. Вода в минералах: Учебное пособие
Шишелова Т. И., Созинова Т. В., Коновалова А. Н.,
4. Метод ИК-спектроскопии,как метод характеристики OnHm-группировок
Наиболее перспективной представляется характеристика OnHm-группировок по их колебательным спектрам [2], так как этот метод, будучи чувствительным к числу внутренних степеней свободы группировки и ее симметрии, позволяет получать разнообразную информацию о ее строении. Колебательный спектр позволяет судить о строении молекул, входящих в первую координационную сферу OnHm-групп.
В методе ИК-спектроскопии наиболее широкое распространение получило исследование ИК-спектров поглощения, возникающих при прохождении ИК-излучения через вещество. При этом выборочно поглощается энергия на тех частотах, которые совпадают с частотами колебаний атомов в молекулах вещества, с частотами вращения молекулы или с частотами колебаний кристаллической решетки. Каждое вещество имеет свой колебательный спектр. Число полос поглощения в спектре, ширина, форма, интенсивность определяются структурой и химическим составом вещества. Это дает возможность по ИК-спектрам проводить качественный и количественный анализы вещества во всех агрегатных состояниях.
Сущность метода ИК спектроскопии состоит в следующем: всякая молекула в энергетическом отношении является электромагнитной системой. Общая энергия молекулы, находящейся на определенном энергетическом уровне, может быть представлена как сумма этих энергий
Е = Еэл + Ек+ Евр.
На рис. 2 приведены энергетические уровни молекулы, находящейся в обычном невозбужденном состоянии <А> (это состояние называют основным состоянием). Более высокие энергетические уровни соответствуют вторым и т.д. возбужденным состояниям <Б>. Каждому электронному уровню соответствует один основной и несколько возбужденных колебательных уровней. Аналогично каждому колебательному уровню соответствует один основной и несколько возбужденных вращательных уровней.

Если нет воздействия на атомы и молекулы, которые переводят их в возбужденное состояние, то все они оказываются на самом низком основном уровне, который является начальным уровнем всех линий поглощения. Если молекула поглощает излучение, то ее энергия повышается и происходит переход с более низкого энергетического уровня на более высокий. Каждая молекула имеет набор дискретных квантовых состояний, которые отличаются друг от друга значениями всех видов энергии.
Совокупность серий полос, отвечающих переходу молекулы с данного колебательного уровня на соседние, представляет собой колебательный спектр. Если переходы сопровождаются поглощением энергии, то спектр называется спектром поглощения.
Спектр поглощения можно получить, если на пути электромагнитного излучения помещено вещество, поглощающее лучи определенных длин волн.
Колебательные уровни молекул расположены на сравнительно близких расстояниях друг от друга так, что частота n колебательного спектра относится к инфракрасной области спектра с длиной волны в несколько микрон. Для колебательных квантовых чисел выполняется правило отбора Δf=+1; это означает, что возможны переходы между соседними уровнями.
При отступлении силы взаимодействия ядер от квазиупругого характера правило отбора нарушается и становятся возможными переходы
Δf = ±1, ±2. Если Δf = 1, переход называется основным; если Δf = 2, то он соответствует обертону первого порядка; если Δf =3 - обертону второго порядка и т.д. Волновое число обертона первого порядка приблизительно вдвое больше, чем у полосы основного перехода. Благодаря этому оказывается, что колебательный спектр двухатомной молекулы состоит из основной полосы поглощения n и обертонов 2n, 3n...nn. Так, для молекулы воды n=3 428 см-1, 2n=6 920 см-1, 3n=10 262 см-1, 4n=13 300 см-1.
Если бы в молекуле существовали лишь колебательные движения ядер, то ее спектр состоял бы из отдельных линий. В действительности на каждое колебательное движение накладывается вращательное движение молекулы. Это ведет к замене отдельной линии полосой, состоящей из большого числа тесно расположенных линий. Следовательно, каждому переходу между двумя колебательными состояниями молекулы отвечает не одна линия, а полоса.
Таким образом, инфракрасные лучи, проходя через вещество, вызывают возбуждение колебательных уровней молекул. Если частота инфракрасного излучения совпадает с частотой колебания молекулы, то происходит резонансное поглощение энергии с образованием полосы поглощения. Она характеризуется частотой колебания (или длиной волны), формой и интенсивностью. Форма инфракрасной полосы поглощения наиболее точно характеризуется графиком k=f(λ), где k - коэффициент поглощения.
В качестве примера на рис. 3 представлен спектр минерала турмалина, на рис. 4 - спектр вермикулита.
Рассмотрение колебательных движений атомов в молекуле позволяет провести классификацию колебаний на два класса: валентные <ν> и деформационные <δ>.
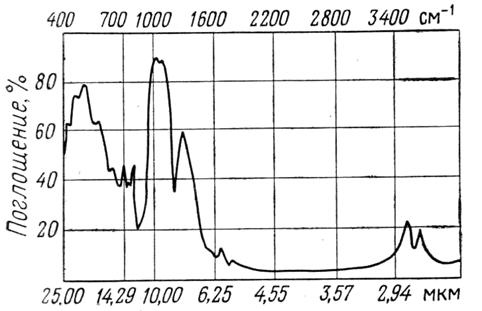
Рис. 3. ИК - спектр турмалина (Na,Ca)(Mg,Al)6[B3Al3Si6(O,OH)30]
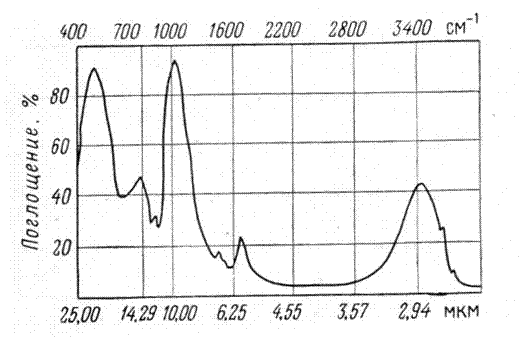
Рис. 4. ИК - спектр вермикулита (Mg,Fe2+,Fe3+)3[(Si,Al)4O10]×(OH)2•4H2O
Валентные колебания (рис. 5) представляют собой растяжение или сжатие связей атомов в молекуле; углы между связями остаются примерно неизменными. Существуют симметричные и антисимметричные колебания.
а) νаs б) νs

Рис. 5. Валентные антисимметричные (а) и симметричные (б) колебания
Деформационные колебания (рис. 6) - это типы колебаний, которые сопровождаются изменением углов между связями молекул. Такие колебания связываются с более низкими величинами силовых постоянных; соответствующие полосы поглощения появляются при более низких частотах по сравнению с валентными.
а) δs б) δаs
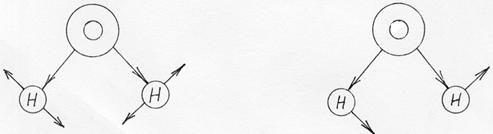
Рис. 6. Деформационные симметричные (а) антисимметричные (б) колебания
Определенные частоты соответствуют колебаниям определенных связей и определенных групп связей в молекуле. Наличие таких частот колебаний - характеристических частот - позволяет делать вывод о строении изучаемых молекул и имеет большое значение для молекулярного спектрального анализа. По ИК-спектрам вещество может быть идентифицировано. Возможно определить симметрию и структуру молекул, термодинамические характеристики; провести количественный анализ, изучить химические равновесия и кинетику химических реакций, контролировать ход технологических процессов.
Частоты максимумов полос поглощения для различных типов колебаний приведены в табл. 1.
Инфракрасный анализ широко внедряется для аналитического и структурного исследования всех веществ, кроме металлов. По сравнению с рентгеновским анализом он имеет то преимущество, что исследуемое вещество может иметь не только твердую, но жидкую и газообразную фазы. Этот метод может быть использован для изучения различных форм воды в минералах для углеводородов, предельных углеводородов, в то время как другие методы исследования для этих целей не пригодны.
Таблица 1
Частоты основных колебаний гидроксилсодержащих соединений в см-1*
|
Системы |
νOH |
δOH |
γOH |
|
Органические кислоты (свободные) |
3590-3490 (2653- ) |
1284-1057 (973-865) |
650-538 (546-421) |
|
Органические кислоты (возмущенные Н-связью) |
3300 -2500 ( -2260) |
1450-950 (1090-940) |
975-830 (701-690) |
|
Спирты (свободные) |
3720-3500 (2760-2655) |
1330-1010 (950-770) |
670-640 (490-475) |
|
Спирты (возмущенные Н-связью) |
3530-2900 (2577-2200) |
1440-1140 (1100-875) |
1090-858 |
|
Неорганические кислоты |
3590-1900 (2655-2200) |
1430-1000 (1086-860) |
1050-650 |
|
Кислые соли |
3300-2200 |
1400-1030 |
1020-400 |
|
Поверхностные ОН-группы (свободные) |
3770-3730 |
870-790 |
|
|
Поверхностные ОН-группы (возмущенные Н-связью) |
3660-3300 |
1150-935 |
|
|
Гидроокиси металлов (щелочных и щелочноземельных) |
3680-3530 |
|
|
|
Гидроокиси металлов (кроме щелочных и щелочноземельных) |
3600-2800 |
1160-840 |
|
* Частоты, указанные в скобках, относятся к соответствующим дейтероаналогам.
Очень существенным результатом классификации колебаний молекул по их форме является то, что определённые частоты колебаний соответствуют определённым связям и определённым группам связей в молекуле. Наличие таких характерных частот колебаний - характеристических частот - позволяет делать вывод о строении изучаемых молекул и имеет большое значение для молекулярного спектрального анализа.
Теория молекулярных спектров достаточно полно изложена во многих монографиях [2-10 и др.] и статьях.