
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
ГЛАВА 2. ПАТОФИЗИОЛОГИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА
При изучении компонентов МС выделяют несколько уровней (табл.1). Основные пути метаболизма углеводов, жиров и белков тесно взаимосвязаны на уровне узловых метаболитов и ключевых ферментов [4;11].
Таблица 1. Уровни развития нарушений при метаболическом синдроме
Дискоординация метаболизма является первоосновой всех нарушений и основывается на существовании определенных ограничений во взаимных превращениях углеводов, жиров и белков, а именно: ограниченные обратные превращения из углеводов жиры, за счет глицерина; использование углеродного скелета, по крайней мере, 3/4 аминокислот (в том числе незаменимых) для глюконеогенеза и вовлечение углеводных структур в биосинтез лишь заменимых аминокислот; способности аминокислот свой углеродный скелет превращать частично или полностью в ацетил-КоА и, таким образом, служить материалом для синтеза жирных кислот. Эти ограничения усугубляются при инсулиновой недостаточности за счет изменения активности ряда ключевых ферментов обмена веществ, катализирующих фосфорилирова-ние глюкозы и фруктозо-6-фосфата, синтез гликогена из УДФ-1-глюкозы, фосфоролиз гликогена до глюкозо-1-фосфата, дефосфо-рилирование глюкозо-6-фосфата путем гидролиза до свободной глюкозы, превращение аминокислот в α-кетокислоты с помощью реакций переаминирования и окислительного дезаминирования, обратное превращение пировиноградной кислоты в фосфоенол-пируват, липолиз триглицеридов, образование ацетоновых тел из ацетил-КоА.
Помимо регуляторов, вмешивающихся в метаболические процессы на уровне ферментных реакций, существует влияние гормонов, связанное с их выбросом в кровеносное русло. Так, адреналин и норадреналин увеличивают скорость липолиза в жировой ткани за счет стимуляции аденилатциклазы адипоцитов и синтеза цАМФ. Действие глюкагона сходно с действием кате-холаминов. Инсулин оказывает противоположное адреналину и глюкагону действие на липолиз и мобилизацию жирных кислот. СТГ, АКТГ также оказывают стимулирующее влияние на липолиз, увеличивая содержание жирных кислот в плазме крови [11].
Жировая ткань обладает ауто-, пара- и эндокринной функцией и секретирует «адипоцитокины», обладающие различным биологическим действием, которые могут (при их избытке - ожирении), вызывать развитие сопутствующих ожирению осложнений, в том числе ИР: лептин, фактор некроза опухоли-а (TNF-а), ингибитор-1 активатора плазминогена (PAI), протеин, стимулирующий ацилирование (ASK), интерлейкин-6, интер-лейкин-8, ангиотензин-П, резистин, адипонектин, адипсин, протеин agouti, трансформирующий фактор роста-β, адипофилин [4; 11;41]. Многие исследователи рассматривают TNF-a, как медиатор ИР при ожирении. TNF-a снижает активность тирозинкиназы инсулинового рецептора, тормозит экспрессию внутриклеточных переносчиков глюкозы ГЛЮТ-4 в мышечной и жировой ткани. Как показано in vivo, TNF-a может действовать в синергизме с интерлейкинами-1 и 6, а также стимулировать секрецию лептина [33].
Лептин - «голос» жировой ткани, регулирует пищевое поведение, воздействуя на центр насыщения в гипоталамусе. К физиологическим эффектам лептина относятся: повышение тонуса симпатической нервной системы, усиление термогенеза в адипоцитах, снижение синтеза инсулина, снижение транспорта глюкозы, воздействуя на инсулиновый рецептор клетки. Выявлено стимулирующее действие лептина на секрецию гонадотро-пинов. В препубертатном периоде уровень лептина параллельно повышается с увеличением массы до максимальных значений с началом полового созревания. В пубертатном периоде повышается чувствительность к лептину. Ожирение может быть связано с дефицитом лептина и лептинорезистентностью [41]. Рецепторы лептина присутствуют и в яичниках, причем непосредственное влияние на стероидогенез в яичниках может быть как стимулирующим, так и ингибирующим (в эксперементах на животных есть данные о снижении инсулинзависимого синтеза прогестерона и Е2 в клетках гранулезы). Выявлено, что в течение менструального цикла уровень лептина постепенно нарастает на протяжении фолликулиновой фазы, достигая пика в лютеиновую фазу [10;11; 19; 27; 47].
Количество инсулина и лептина в циркуляторном русле прямо пропорционально массе жировых отложений, и их называют «сигналами ожирения» Повышенный уровень лептина при лептинорезистентности и МС обусловливает развитие гормональной дисфункции и висцерального ожирения. Глюкокор-тикоидная нестабильность (внутриклеточный гиперкортицизм) при метаболическом синдроме и инсулинорезистентности так же приводит к развитию висцерального ожирения [51].
В транспорте половых стероидов активную роль играет циркулирующий ГСПС (глобулин, связывающий половые стероиды, или тестостерон-эстрадиол связывающий глобулин). Установлено, что количество ГСПС определяется как наследственными факторами, так и наличием некоторой экстрагенитальной и генитальной патологии. Наличие положительной корреляции между уровнем ГСПС и ХС ЛПВП и обратной между ГСПС и ХС ЛПНП и ЛПОНП обуславливает наследование данного глобулина как генетического фактора риска развития атеросклероза сосудов головного мозга, ИБС и АГ [19]. Установлена прямая корреляция между содержанием эстрона, 17β-эстрадиола и индексом массы тела, обратная корреляция существует между последним показателем и уровнем ГСПС в сыворотке крови, что особенно характерно для пациенток в периоде постменопаузы [38]. Снижение уровня ГСПС в постменопаузе приводит к росту концентрации свободного тестостерона, относительной гиперандрогении и вносит определенный вклад в формирование абдоминального ожирения. Отмечено, что у женщин с гиноидным типом распределения жировой клетчатки уровень ГСПС выше, чем у таковых с андро-идным типом [48].
При исследовании сыворотки крови пациенток, страдающих сахарным диабетом, было установлено, что нарастание уровня глюкозы и повышение уровня инсулина ведут к увеличению свободного тестостерона и понижению уровня ГСПС [11]. Есть данные о том, что у женщин с анамнестически ранним менархе (до 13 лет), в репродуктивном возрасте уровень ГСПС в сыворотке крови более низкий по сравнению с женщинами с поздним менархе [2].
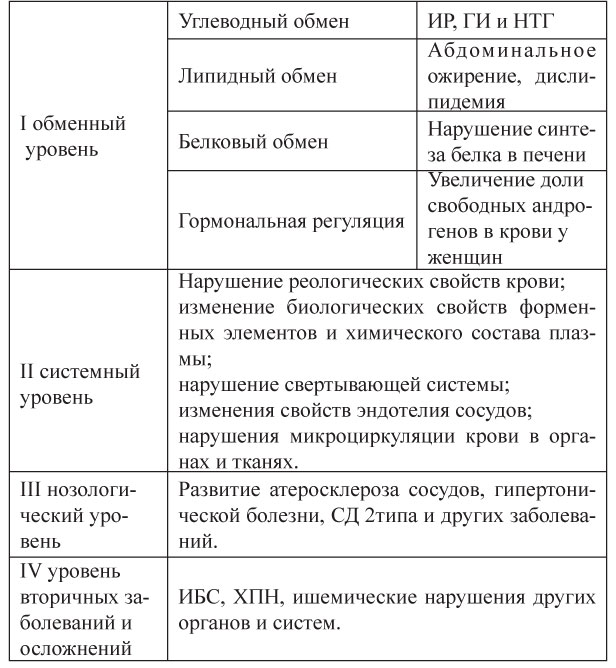
Ключевым моментом в первичных метаболических нарушениях является формирование инсулинорезистентности. Под ИР в настоящее время понимают первичное, селективное и специфическое нарушение биологического действия инсулина, сопровождающееся снижением потребления глюкозы тканями (преимущественно скелетными мышцами) и приводящее к хронической ГИ. Селективный характер ИР означает, что отдельные эффекты инсулина сохраняются, например, реабсорбция натрия в почечных канальцах или влияние на симпатический отдел нервной системы (схема 1).
Практически все составляющие МС являются факторами риска развития сердечно-сосудистых заболеваний, а в сочетании многократно ускоряют их развитие. Причем сочетания отдельных компонентов могут рассматриваться в рамках МС только при наличии ИР. Разумеется, не все компоненты метаболического синдрома встречаются одновременно. Каким фенотипом проявится метаболический синдром, зависит от взаимодействия факторов генетических и внешней среды.
Патогенез дислипидемии при метаболическом синдроме
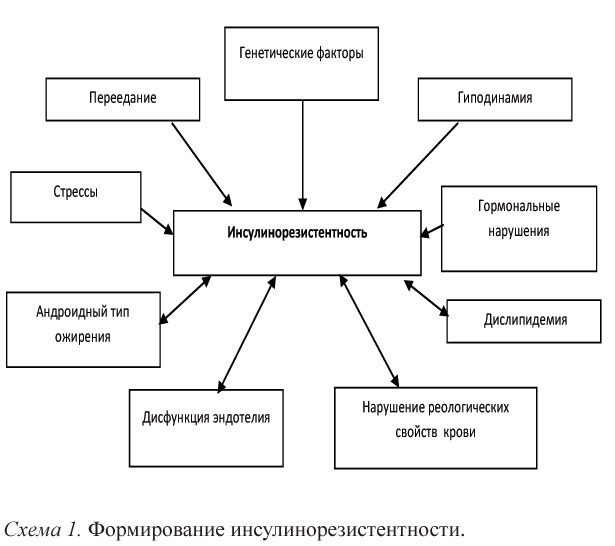
Наиболее частым вариантом дислипидемии при метаболическом синдроме является липидная триада: сочетание гипер-триглицеридемии, низкого уровня ХС ЛПВП и повышения фракции мелких плотных частиц ХС ЛПОНП, переносчиков тригли-церидов, что является результатом их повышенной печеночной продукции и сниженной элиминации. Механизм влияния ИР на развитие липидных нарушений представлены на схеме 2.
Гиперинсулинемия способствует увеличению пролиферации гладкомышечных клеток и фибропластов, увеличению активности рецепторов ХС ЛПНП и синтезу эндогенного ХС в клетках сосудистой стенки, коллагена, стимуляции выработки ИПФР.
Патогенез развития артериальной гипертензии при метаболическом синдроме
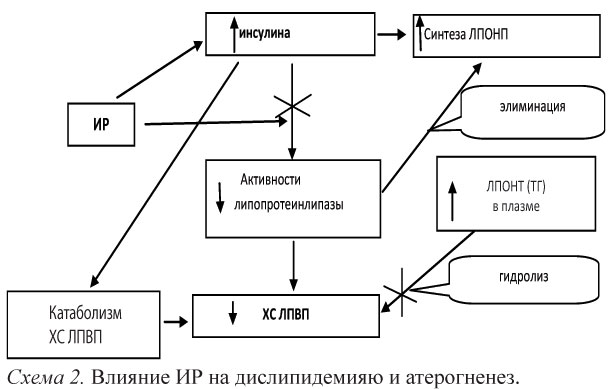
Механизм развития АГ при МС многогранен и неоднозначен. Общее влияние инсулина на АД представляет собой равновесие между прямым вазодилататорным и непрямым вазокон-стрикторным эффектами. При хронической ГИ возникает парадоксальная реакция со стороны сосудов в связи с преобладанием митогенного и симпатикостимулирующего компонентов (схема 3).
С другой сторон, возможен механизм, посредством которого АГ может сама способствовать ИР. Увеличение активности симпатической нервной системы, возникающей при АГ, вызывает понижение объемного кровотока в капиллярах скелетной мускулатуры в результате их вазоконстрикции, что увеличение пути диффузии глюкозы к клеткам и приводит к инсулинорезистент-ности.
Эндотелий сосудов обладает метаболической и секреторной активностью и играет ключевую роль в регуляции тонуса и проницаемости сосудов. Уникальное положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке.
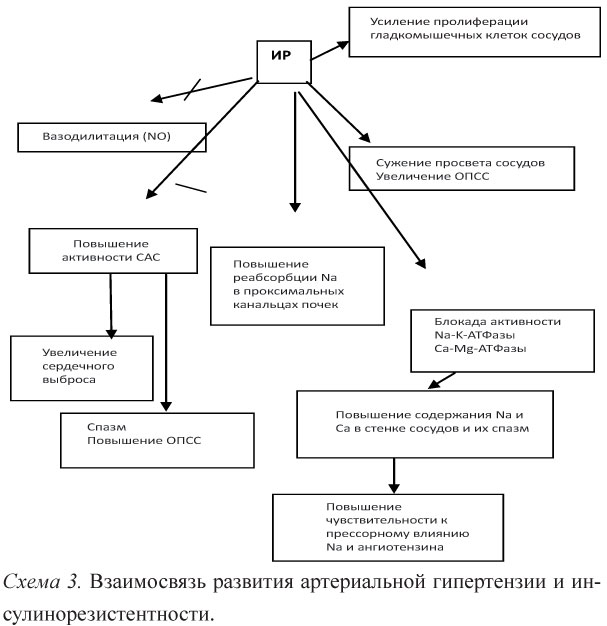
В настоящее время есть две основные точки зрения относительно формирования эндотелиопатии. Первая, что при синдроме ИР развивается дисфункция эндотелия сосудов и, в частности, нарушается синтез оксида азота в сосудистой стенке (оксид азота является мощным вазодилататором). Он оказывает сдерживающее влияние на пролиферацию гладкомышечных клеток, тормозит адгезию моноцитов к эндотелию сосудистой стенки, снижает перекисное окисление липидов, т.е. предохраняет стенки сосудов от повреждения. Существует также мнение, что дисфункция эндотелия является не следствием, а причиной в развитии ИР, одним из первичных дефектов, лежащих в основе ее развития. В случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается, что может способствовать развитию ИР. Однако, до настоящего времени не получено достаточно данных в пользу первичной или вторичной роли эндотелиопатии в генезе инсулино-резистентности [4; 6]. Итак, основные механизмы повышения АД:
- объемозависимый
- повышение активности ренин-ангиотензин-адьдостеро-новой и симпатоадреналовой систем
- дисфункция эндотелия
- гиперлептинемия
- блокада вазодилатирующего эффекта инсулина.
Имеются данные, указывающие на снижение фибриноли-тической активности у пациентов с МС. PAI-1 является основнымингибитором активатора плазминогена, обеспечивая до 60% общейингибиторной активности в отношении активаторов плазминогена вплазме. Повышение уровня PAI-1 связано с риском тромбозов. PAI-1 синтезируется эндотелиальными клетками, моноцитами, макрофагами, гладкомышечными клетками, адипоцитами висцеральнойжировой ткани. Эндотелиальные клетки и тромбоциты регулируютвыделение PAI-1 в процессе фибринолиза. Было установлено, чтоГИ, гипергликемия и гипертриглицеридемия приводят к значительному повышению экспрессии гена, ответственного за продукциюPAI-1, и, соответственно, к повышению концентрации в крови. Внастоящее время считается, что повышение уровня PAI-1 являетсямаркером высокого риска инфаркта миокарда, ассоциируется ссахарным диабетом [4].
