
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
ПОКАЗАТЕЛИ КИСЛОТНОСТИ ПО ГЛУБИНЕ ПРОБ ПОЧВЫ (С.П. Семенова, магистрант (ЗОС-51))
Реакция почвенного раствора является важным свойством почвы. Отдельные растения требуют определенных интервалов реакции почвы для нормального развития; энергия жизнедеятельности микроорганизмов также значительно зависит от реакции почвы (в кислой среде преобладает грибная флора, а в слабощелочной - бактериальная). С реакцией почвенной среды связаны процессы почвообразования: разрушения и превращения минеральной и органической частей почвы (растворение, образование осадков, диссоциация, образование устойчивых органо-минеральных соединений, миграция и аккумуляция веществ в почвенном профиле). Реакция почвенного раствора является важным фактором плодородия почв [1].Кислотность почв - способность почвы подкислять воду и растворы нейтральных солей. Она обусловлена находящимися в почвенном растворе органическими и минеральными кислотами, кислыми и гидролитически кислыми солями, а также обменными ионами Η+ и Αl3+.
Различают две формы кислотности: актуальную (реакция почвенного раствора) и потенциальную (реакцию твердой фазы почвы).
Актуальной кислотностью называют кислотность почвенного раствора. Ее значение зависит от количества органических и минеральных кислот в почвенном растворе. Активную кислотность выражают величиной водного рН (Н2О). Реакция почвенного раствора определяется концентрацией находящихся в нем ионов водорода (Н+) и гидроксила (ОН). При электрической диссоциации воды образуется равное количество ионов водорода и гидроксила. При этом концентрация ионов водорода в чистой воде, имеющей нейтральную реакцию, равна 10-7 г на л Н+. Если в воде растворена кислота, то количество ионов водорода в растворе увеличивается.
Но пользоваться величиной концентрации ионов водорода в г на л раствора на практике неудобно. Поэтому для упрощения обозначения концентрации ионов водорода ее выражают символом рН, представляющим собой отрицательный логарифм концентрации ионов водорода почвенного раствора. Так, при концентрации ионов водорода 10-3 г на л, рН будет равна 3; при 10-6 - 6; при 10-8 - 8 и т.д.
Потенциальная кислотность (кислотность твердой массы) обусловлена ионами Н+ и Аl3+, находящимися в поглощенном состоянии в почвенно-поглощающем комплексе. Потенциальную кислотность в зависимости от характера вытеснения Н+ и Аl3+ подразделяют на два вида: обменную и гидролитическую.
Обменная кислотность - кислотность почвенного раствора, образующая при вытеснении Н+ и Аl3+ раствором нейтральной соли (КСl).
В зависимости от обменной кислотности (рНКСl) различают: сильнокислые (рН меньше 4,5), среднекислые (рН 4,6 - 5,0), слабокислые (рН 5,1 - 5,5), близкие к нейтральным (рН 5,6 - 6,0), нейтральные (рН 6,0 - 7,0) и рН более 7 - щелочные почвы. По обменной кислотности рассчитывают дозы извести для нейтрализации кислотности почв.
Гидролитическая кислотность выражается в мг.-экв. на 100 г почвы. В кислых почвах обменная кислотность всегда меньше гидролитической, т.к. является ее частью.
Кислотность почвы является ее отрицательным свойством: угнетает рост и развитие культурных растений, жизнедеятельность почвенных микроорганизмов, усиливает разрушение минеральной части почвы, вызывая процессы подзолообразования. Кроме того, катионы алюминия токсичны для растений. В целом кислотность снижает почвенное плодородие и урожайность сельскохозяйственных культур.
По данным [2] в таблице 1 приведены исходные данные для факторного анализа, причем вне зависимости от типа пробной площадки и горизонтов почвенного разреза.
Таблица 1
Кислотность почвы и грунта на глубине взятия проб
|
Глубина |
рН водный |
рН солевой |
Гидролит. кислотность |
Глубина |
рН водный |
рН солевой |
Гидролит. кислотность |
|
5-15 |
6.92 |
5.89 |
5.69 |
5-15 |
5.55 |
4.28 |
11.97 |
|
30-40 |
7.21 |
6.24 |
6.24 |
23-39 |
5.17 |
3.4 |
13.37 |
|
45-55 |
7.47 |
6.17 |
6.17 |
40-50 |
5.35 |
3.47 |
14.26 |
|
50-70 |
7.42 |
6.7 |
6.70 |
60-70 |
5.56 |
3.65 |
9.68 |
|
86-96 |
7.65 |
6.43 |
6.43 |
90-100 |
7.15 |
4.75 |
1.96 |
|
0-20 |
7.25 |
5.95 |
2.90 |
130-140 |
8.05 |
6.62 |
1.20 |
|
20-30 |
7.39 |
6.13 |
2.48 |
4-15 |
5.92 |
4.3 |
8.58 |
|
30-70 |
7.08 |
5.98 |
2.70 |
17-36 |
5.86 |
3.63 |
7.18 |
|
70-100 |
7.82 |
5.9 |
1.3 |
36-68 |
5.95 |
3.72 |
7.09 |
|
2-16 |
6.2 |
5.17 |
5.99 |
68-101 |
6.8 |
5.4 |
1.93 |
|
20-30 |
6.12 |
4.6 |
7.00 |
101-150 |
8.53 |
7.49 |
0.61 |
|
32-42 |
5.82 |
4.2 |
6.98 |
1-22 |
6 |
4.52 |
8.14 |
|
50-60 |
6.07 |
3.98 |
7.48 |
22-37 |
6.2 |
4.41 |
7.26 |
|
70-80 |
6.41 |
4.7 |
2.90 |
37-68 |
7.45 |
6.5 |
1.14 |
|
95-134 |
7.01 |
5.01 |
3.50 |
68-120 |
8.02 |
6.9 |
1.70 |
|
134-170 |
8.35 |
7.14 |
0.99 |
1-29 |
6.54 |
4.45 |
5.16 |
|
210-230 |
8.1 |
7.29 |
1.50 |
29-55 |
6.76 |
5.28 |
2.45 |
|
2-17 |
5.65 |
4.35 |
9.98 |
55-83 |
7.09 |
5.62 |
1.93 |
|
20-30 |
5.67 |
3.51 |
10.07 |
83-144 |
7.02 |
5.58 |
1.66 |
|
34-44 |
5.58 |
3.39 |
11.7 |
144-150 |
7.12 |
5.8 |
1.58 |
|
60-70 |
5.59 |
5.51 |
0.50 |
1-27 |
6.09 |
5.08 |
6.39 |
|
80-90 |
5.93 |
4.05 |
4.99 |
24-41 |
6.5 |
5.09 |
4.90 |
|
125-135 |
7.06 |
4.72 |
1.70 |
41-70 |
6.84 |
5.1 |
2.45 |
|
180-190 |
8.22 |
7.13 |
0.50 |
70-105 |
6.93 |
5.03 |
2.01 |
|
|
|
|
|
105-150 |
6.92 |
5.21 |
2.45 |
Нами ставилась задача выявления биотехнических закономерностей, которые позволили бы выразить солевую и гидролитическую кислотность через водную кислотность.
Для записи формул примем следующие условные обозначения:
pH - кислотность водная;
pHc - кислотность солевая;
pHг - кислотность гидролитическая.
Связь между первыми двумя факторами (рис. 1) определяется уравнением показательного закона
![]() . (1)
. (1)
Отсюда следует, водная кислотность с коэффициентом корреляции 0,9189 вполне может заменить солевую кислотность. Поэтому параметр почвы pHc был исключен из факторного анализа.
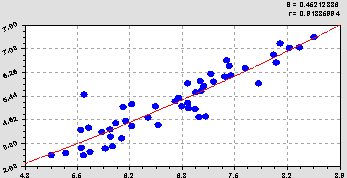
Рис. 1. График сравнения рН водного (абсцисса) с рН солевым (ордината)
Гидролитическая кислотность (рис. 2) получает закон экспоненциальной гибели по формуле
![]() . (2)
. (2)
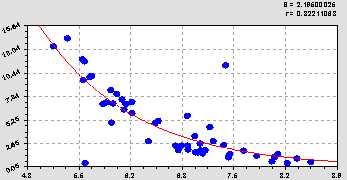
Рис. 2. График сравнения рН водного (абсцисса) с гидролитической кислотностью
Из-за непропорциональной факторной связи и меньшего значения коэффициента корреляции 0,8221 гидролитическая кислотность была оставлена для проведения факторного анализа свойств почвы.
Литература
- Захаров, К.К. Основы почвоведения и географии почв: Учебное пособие / К.К. Захаров. - Йошкар Ола: МарГТУ, 1999. - 342 с.
- Экология города Йошкар-Олы: научное издание / Мар.гос.ун-т; отв.ред. О.Л. Воскресенская. - Йошкар Ола, 2007. - 300 с.
