
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2.3. Области существования различных комплексов данного комплексообразователя в зависимости от концентрации лиганда
Возьмем в качестве примера цианидный комплекс ртути (II), для которого в справочной литературе имеются значения частных констант нестойкости. Этот комплекс в водном растворе подвергается ступенчатой диссоциации:
[Hg(CN)4]2– D [Hg(CN)3]– + CN–; pk1 = 3,0 (A)
[Hg(CN)3]– D [Hg(CN)2] + CN–; pk2 = 3,8 (Б)
[Hg(CN)2] D [HgCN]+ + CN–; pk3 = 16,7 (В)
[HgCN]+ D Hg2+ + CN–; pk3 = 18,0 (Г)
Таким образом, в водном растворе в общем случае могут сосуществовать как различные комплексные частицы [Hg(CN)4]2–, [Hg(CN)3]– , [Hg(CN)2], [HgCN]+, так и гидратированные катионы комплексообразователя. Преобладание той или иной формы комплексных частиц определяется концентрацией лиганда CN–: чем эта концентрация больше, тем в большей степени все равновесия смещены в сторону образования комплексов с большим содержанием лиганда. Так, если к раствору, содержащему только гидратированный катион (например, к раствору Hg(NO3)2) постепенно и осторожно добавлять раствор, содержащий лиганд (например, раствор KCN), то в первую очередь образуется комплексная частица, обладающая наибольшей устойчивостью, то есть та, для которой константа нестойкости k имеет наименьшее значение или, что то же самое, pk имеет наибольшее значение. В нашем примере это [HgCN]+. По мере увеличения концентрации CN– равновесие (Г) все больше смещается влево, концентрация свободных катионов Hg2+ уменьшается, а комплексных частиц [HgCN]+ увеличивается. Дальнейшее увеличение концентрации лиганда влечет за собой смещение в левую сторону равновесия (В), а это означает, что концентрация [HgCN]+, достигнув определенного максимума, начинает уменьшаться, так как превращается в все большей степени в [Hg(CN)2] и так далее. Отсюда ясно, что любой заданной концентрации лиганда CN– соответствует преобладающая концентрация того или другого комплекса, тогда как остальные комплексы присутствуют в растворе в столь незначительных концентрациях, что ими часто можно пренебречь.
Иными словами, данная ситуация абсолютно аналогична той, которая была описана в параграфе 1.1.3 для случая преимущественного существования различных форм слабых кислот в зависимости от рН раствора. Не повторяя всех рассуждений, приведенных в указанном параграфе, составим схему преимущественного существования различных цианидных комплексов ртути (II) в зависимости от p[CN–] (рис. 3):
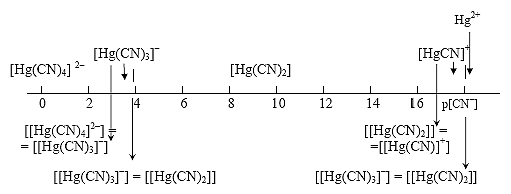 .
.
Рис. 3. Области существования различных цианидных комплексов ртути(II) в зависимости от концентрации лиганда
Схема показывает, что при ничтожных концентрациях лиганда [CN–]<<10–18моль/л (p[CN–] > 18) в растворе присутствуют практически только гидратированные катионы Hg2+. В интервале концентраций лиганда 10–18,0 ¸ 10–16,7 моль/л в растворе преобладают комплексные частицы [HgCN]+; при 10–16,7 < [CN–] < 10–3,8 моль/л преимущественной формой является комплекс [Hg(CN)2] и так далее. Если же концентрация лиганда превышает 0,001моль/л (pK < 3), то в растворе практически существуют только комплексы [Hg(CN)4]2–.
Очевидно, что аналогичные схемы можно построить и для любого другого комплекса, если для него известны ступенчатые константы диссоциации (что, к сожалению, далеко не всегда имеет место).
