
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2.4. Реакции обмена лигандов
Пусть имеется два раствора, один из которых содержит комплекс [Co(CN)4]2–, а другой - [Cu(CN)4]2–. Константы нестойкости этих комплексов соответственно равны К1 = 10–19,1 (рК1 = 19,1) и К2 = 10–27,3 (рК2 = 27,3).
В каждом из растворов устанавливается равновесие между донором (D) и сопряженным с ним акцептором (А):
[Co(CN)4]2– D Co2+ + 4CN–; K1 = 10–19,1
D1 А1
[Cu(CN)4]2– D Cu2+ + 4CN–; K1 = 10–27,3
D2 А2
Численные значения констант нестойкости показывают, что цианидный комплекс меди (II) значительно устойчивее комплекса кобальта (II), иными словами, из двух доноров D1 значительно сильнее, чем D2, так как первый из них легче отдает свои лиганды, чем второй, следовательно, из двух акцепторов А2 намного сильнее, чем А1.
Если теперь растворы слить, то произойдет взаимодействие между двумя сопряженными донорно-акцепторными парами. При этом, согласно общему правилу, равновесие сместится в сторону той реакции, в которой более сильный донор взаимодействует с более сильным акцептором:
[Co(CN)4]2– + Cu2+ D Co2+ + [Cu(CN)4]2–
D1 А2 -> А1 D2
Представляет интерес выяснить, насколько сильно данное равновесие сдвинуто вправо, то есть насколько полно протекает эта реакция обмена лигандами. Для этого запишем выражение константы равновесия этой реакции:
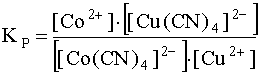 .
.
Умножим и разделим данную дробь на [CN–]4 и представим ее в следующем виде:
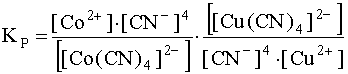 .
.
Первый сомножитель этого выражения представляет собой константу К1, а второй – ![]() , то есть
, то есть
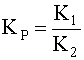 (14)
(14)
Для рассматриваемого примера
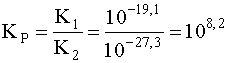 .
.
Иногда соотношение (14) удобнее представить в логарифмической форме:
lgKP = lgK1 - lgK2
![]() (15)
(15)
Соотношения (14) и (15) являются еще одним подтверждением общего правила, согласно которому всякая реакция между комплексами всегда протекает в сторону образования более устойчивого комплекса, причем она протекает в этом направлении тем полнее, чем больше численные значения констант нестойкости комплексов отличаются друг о друга.
В рассмотренном примере участвующие в реакции комплексы, имеющие один и тот же лиганд, отличались друг от друга комплексообразователями, но совершенно очевидно, что сформулированное правило справедливо и тогда, когда в реакции участвуют комплексы, образованные одним и тем же катионом - комплексообразователем с различными лигандами. Так, если к раствору, содержащему хлоридный комплекс ртути (II) добавить достаточное количество анионов I–, то хлоридный комплекс будет практически нацело разрушен, а вместо него образуется иодидный комплекс:
[HgCl4]2– + 4I– D [HgI4]2– + 4Cl–
K1=10–15,2 K2=10–30,0
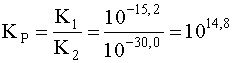 .
.
О том, что данное равновесие практически нацело будет смещено в прямом направлении, убедительно свидетельствует очень большое численное значение константы равновесия.
