
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.3.2. Уравнение Нернста и его различные формы
Окислительно-восстановительной системе, записанной в общем виде
aOx + ne– D bRed
соответствует наиболее общая форма уравнения Нернста:
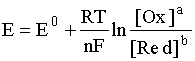 .
.
Если заменить натуральный логарифм десятичным и подставить соответствующие значения постоянных величин в предлогарифмическом сомножителе, то для температуры 298 К уравнение имеет вид
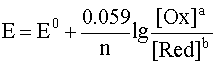 .
.
В дальнейшем будем пользоваться округленным значением числовой константы в логарифмическом слагаемом, что значительно упрощает расчеты, не внося в их результат существенной ошибки:
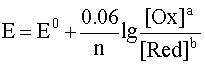 .
.
Например, для полуреакции
Sn4+ + 2e– D Sn2+
уравнение Нернста имеет вид:
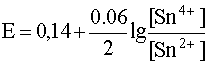 .
.
В различных частных случаях, в зависимости от характера полуреакции, уравнение Нернста записывается по-разному:
1. Полуреакции
aA + bB + ... + ne– D mM + nN + ...
соответствует потенциал
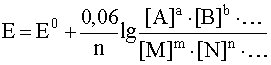 .
.
Например, для окислительно-восстановительной системы
Cr2O72– + 14H+ + 6e– D 2Cr3+ + 7H2O
потенциал выражается уравнением
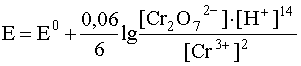 .
.
Обратим внимание на то, что в достаточно разбавленных водных растворах концентрацию воды можно считать величиной постоянной, поэтому она не фигурирует в знаменателе дроби, но в неявном виде входит в состав константы Е0. Данная форма уравнения Нернста соответствует тому весьма распространенному и важному случаю, когда окислительно-восстановительное равновесие протекает с участием среды.
2. Если окислительно-восстановительная система включает в себя малорастворимое вещество, то его концентрация, будучи также величиной постоянной, не включается в логарифмический член уравнения Нернста. Так, для полуреакции
MnO4– + 4H+ +3e– D MnO2(Т) + 2H2O
уравнение Нернста имеет вид
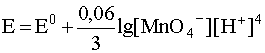 .
.
3. Для металлических электродов, то есть для окислительно-восстановительных систем, представляющих собой металл, контактирующий с раствором, содержащим катионы этого же металла, например, для электрода
Zn2+ + 2e– D Zn(T)
уравнение Нернста включает только концентрацию катионов металла в растворе, то есть
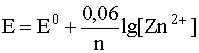 .
.
4. Если окислительно-восстановительная система включает в себя малорастворимый в воде газ (H2, O2, N2 и т.д.), то в уравнение Нернста входит не концентрация этого газа, а его парциальное давление. Например, для системы
О2(Г) + 4Н+ + 4е– D 2H2O
уравнение Нернста должно быть записано следующим образом:
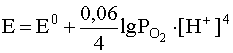 .
.
Однако в обычных условиях парциальное давление газа равно атмосферному, раствор насыщен этим газом, следовательно, еcть величина постоянная, и она входит в константу Е0, поэтому для данного случая
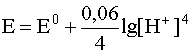 .
.
