
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.1.1 Растворимость осадков в зависимости от кислотности среды
Среди малорастворимых соединений в неорганической химии чаще всего фигурируют нерастворимые гидроксиды, а также соли. Среди малорастворимых солей наиболее многочисленную группу образуют соли слабых кислот, поэтому в центре нашего внимания будут именно эти соли.
Как гидроксиды, так и соли слабых кислот содержат в своем составе частицы, чувствительные к кислотности среды. В случае гидроксидов это гидроксогруппы ![]() , а в случае солей слабых кислот – это анионы, т.к. последние в зависимости от кислотности раствора в большей или меньшей степени подвергаются протолизу. В обоих случаях на основное гетерогенное равновесие (43) накладываются равновесия, сопровождающиеся переносом протона, что может существенно повлиять на растворимость малорастворимого соединения
, а в случае солей слабых кислот – это анионы, т.к. последние в зависимости от кислотности раствора в большей или меньшей степени подвергаются протолизу. В обоих случаях на основное гетерогенное равновесие (43) накладываются равновесия, сопровождающиеся переносом протона, что может существенно повлиять на растворимость малорастворимого соединения ![]() .
.
Растворимость гидроксидов. Рассмотрим гипотетический простейший гидроксид ![]() . В общем случае гидроксиды являются амфолитами, т.е. в принципе могут вести себя и как основания, и как кислоты. Те гидроксиды, которые обычно причисляют к основаниям или кислотам, можно рассматривать как предельные случаи, когда доминирующей является либо основная, либо кислотная функция.
. В общем случае гидроксиды являются амфолитами, т.е. в принципе могут вести себя и как основания, и как кислоты. Те гидроксиды, которые обычно причисляют к основаниям или кислотам, можно рассматривать как предельные случаи, когда доминирующей является либо основная, либо кислотная функция.
Пусть гидроксид является амфолитом. Его основная функция выражается рвновесием
МОН + Н+![]() М+ + Н2О
М+ + Н2О
Напишем выражение константы этого равновесия в форме
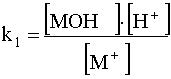 .
.
Кислотную функцию того же гидроксида можно представить равновесием
МОН![]() МО¯ + Н+
МО¯ + Н+
и соответствующей константой равновесия
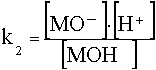 .
.
В насыщенном растворе, кроме того, существует равновесие
МОН(т)![]() МОН(р),
МОН(р),
причем, как было замечено ранее, равновесная концентрация недиссоциированных молекул гидроксида![]() мала и является постоянной величиной:
мала и является постоянной величиной:
![]() .
.
Попутно заметим, что всегда
![]() , т.е.
, т.е. ![]() .
.
Здесь ![]() и
и ![]() представляют собой десятичный логарифм констант
представляют собой десятичный логарифм констант ![]() и
и ![]() , взятый с обратным знаком.
, взятый с обратным знаком.
Растворимость (S) гидроксида с учетом всех его форм, которые могут существовать в водном растворе, выражается уравнением материального баланса:
![]() .
.
Выразим равновесные концентрации частиц ![]() и
и![]() через соответствующие константы равновесия:
через соответствующие константы равновесия:
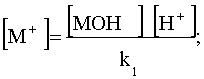
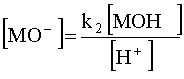 .
.
Тогда растворимость гидроксида Sимеет вид:
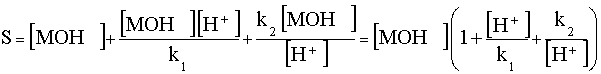 .
.
При выражении концентрации ионов водорода в виде рН, а![]() и
и![]() в виде
в виде![]() и
и![]() соответственно, а также с учетом того, что
соответственно, а также с учетом того, что ![]() , получим:
, получим:
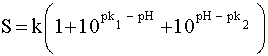 (45)
(45)
Полученную зависимость для большей наглядности удобно представить графически, сделав следующие допущения: пусть ![]() . В этом случае единицей и вторым слагаемым можно пренебречь, т.к. при
. В этом случае единицей и вторым слагаемым можно пренебречь, т.к. при![]() (что и наблюдается чаще всего в химической практике) это слагаемое будет очень малой величиной, не вносящей заметного вклада в растворимость гидроксида. При таком допущении
(что и наблюдается чаще всего в химической практике) это слагаемое будет очень малой величиной, не вносящей заметного вклада в растворимость гидроксида. При таком допущении
![]() .
.
График этой функции представляет собой кривую, круто нисходящую с увеличением рН вплоть до значения S=k. При значениях![]() в растворе будут, в основном, содержаться катионы
в растворе будут, в основном, содержаться катионы ![]() .
.
Пусть рН>pk2. В этом случае можно пренебречь единицей и слагаемым ![]() из-за их малости по сравнению с слагаемым
из-за их малости по сравнению с слагаемым ![]() . Тогда
. Тогда ![]()
Соответствующая кривая является круто восходящей при уменьшении кислотности раствора (т.е. при увеличении рН). Эта кривая ограничивает ту область значений рН, при которых в растворе доминирует продукт растворения гидроксида МОНв сильно щелочных растворах, т.е. анионы ![]() .
.
Пусть pk1<pH<pk2.В этом интервале рН оба логарифмических члена очень малы по сравнению с единицей. Тогда ![]() , растворимость гидроксида минимальна и не зависит от рН раствора.
, растворимость гидроксида минимальна и не зависит от рН раствора.
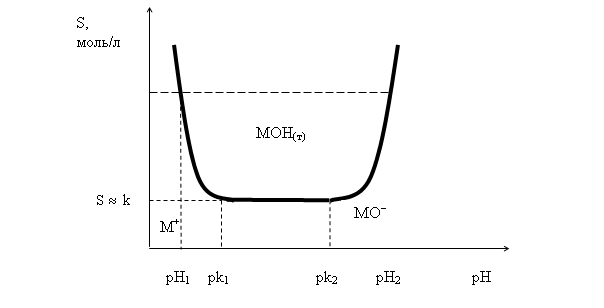
Кривая растворимости, соответствующая уравнению (45) с учетом принятых допущений, представлена на рис. 11.
 .
.
Рис. 11. Зависимость растворимости Sгидроксида от величины рН
Анализ уравнения (45) и кривой, представленной на рис.11, позволяют сделать следующие практически важные выводы.
1.В общем случае для амфотерного гидроксида существует определенный интервал значений рН, внутри которого он существует в виде малорастворимого осадка. Минимальное значение рН, при котором этот осадок начинает образовываться, обычно называютрН гидратообразования. Как следует из рис. 11, рН гидратообразования зависит не только от природы гидроксида, которая отражена в величине его константы ![]() , но и от исходной концентрации катионов
, но и от исходной концентрации катионов ![]() в растворе. Для заданной исходной концентрации этих катионов при постепенном подщелачивании раствора существует определенное значение рН, по достижении которого и дальнейшем повышении осадок гидроксида растворяется. Это значение называетсярН растворения гидроксида.
в растворе. Для заданной исходной концентрации этих катионов при постепенном подщелачивании раствора существует определенное значение рН, по достижении которого и дальнейшем повышении осадок гидроксида растворяется. Это значение называетсярН растворения гидроксида.
2.Кривая, представленная на рис. 11, является идеальной и относится к простейшему гипотетическому гидроксиду. Реальные малорастворимые в воде гидроксиды часто по тем или иным причинам не укладываются по своим свойствам в эту простую схему. Отклонения от идеальной кривой, а иногда и полная ее трансформация, происходят по разным причинам. Так, если катион гидроксида обладает достаточно сильными кислотными свойствами, т.е. когда![]() и
и![]() этого гидроксида достаточно малы, то вся кривая растворимости сильно сдвигается влево. Поэтому в некоторых случаях левая ветвь кривой полностью отсутствует, т.к. значения рН, при которых эта ветвь имеет место, просто недостижимы в обычной практике. Это относится, в первую очередь, к малым по размеру катионам, имеющим высокий положительный электрический заряд. Обычно говорят, что такие катионы не способны к существованию в водном растворе. Типичным примером может служить Si(OH)4. Это соединение, приведенная формула которого в известной степени условна, называют ортокремниевой кислотой. Даже в сильно кислой среде это малорастворимое соединение не растворяется и, таким образом, катионы Si4+в растворе отсутствуют. В сильно щелочных растворах ортокремниевая кислота заметно растворяется и ортосиликат-анионы
этого гидроксида достаточно малы, то вся кривая растворимости сильно сдвигается влево. Поэтому в некоторых случаях левая ветвь кривой полностью отсутствует, т.к. значения рН, при которых эта ветвь имеет место, просто недостижимы в обычной практике. Это относится, в первую очередь, к малым по размеру катионам, имеющим высокий положительный электрический заряд. Обычно говорят, что такие катионы не способны к существованию в водном растворе. Типичным примером может служить Si(OH)4. Это соединение, приведенная формула которого в известной степени условна, называют ортокремниевой кислотой. Даже в сильно кислой среде это малорастворимое соединение не растворяется и, таким образом, катионы Si4+в растворе отсутствуют. В сильно щелочных растворах ортокремниевая кислота заметно растворяется и ортосиликат-анионы![]() способны к самостоятельному существованию в водном растворе. Иными словами, для гидроксида Si(OH)4практически отсутствует левая нисходящая ветвь кривой растворимости.
способны к самостоятельному существованию в водном растворе. Иными словами, для гидроксида Si(OH)4практически отсутствует левая нисходящая ветвь кривой растворимости.
Аналогичное явление имеет место и для гидроксида B(OH)3, который называют ортоборной кислотой.
В том случае, когда катион малорастворимого гидроксида обладает кислотными свойствами в ничтожно малой степени, т.е. когда![]() и
и![]() достаточно велики, вся кривая растворимости сильно сдвигается вправо и на ней может отсутствовать правая восходящая ветвь, отвечающая растворению гидроксида в сильно щелочной среде – такая среда для подобного рода гидроксидов оказывается практически недостижимой. Это случай малорастворимых гидроксидов, у которых значительно преобладают основные свойства – например, гидроксиды магния, железа (II), кадмия и т.д.
достаточно велики, вся кривая растворимости сильно сдвигается вправо и на ней может отсутствовать правая восходящая ветвь, отвечающая растворению гидроксида в сильно щелочной среде – такая среда для подобного рода гидроксидов оказывается практически недостижимой. Это случай малорастворимых гидроксидов, у которых значительно преобладают основные свойства – например, гидроксиды магния, железа (II), кадмия и т.д.
3.Иногда в результате изменения рН среды кривая растворимости претерпевает изменения в результате целого ряда побочных явлений. Так, для гидроксидов, имеющих две и более гидроксогруппы в своем составе, в ходе изменения кислотности раствора возможно образование основных солей, которые зачастую являются малорастворимыми соединениями. В этом случае кривая растворимости меняет свой вид, потому что на поведение собственно гидроксида накладывает отпечаток и образующаяся на определенном этапе основная соль, свойства которой (в частности, растворимость) могут существенно отличаться от свойств рассматриваемого гидроксида.
Другим «возмущающим фактором», способным повлиять на закономерности образования и растворения гидроксида, является образование гидроксокомплексов. Ведь когда среда раствора постепенно смещается в щелочную сторону, то это означает, что в растворе увеличивается концентрация гидроксоанионов, что, в свою очередь, способствует образованию гидроксокомплексов, как правило, хорошо растворимых в воде. Это также может привести к определенным деформациям кривой растворимости.
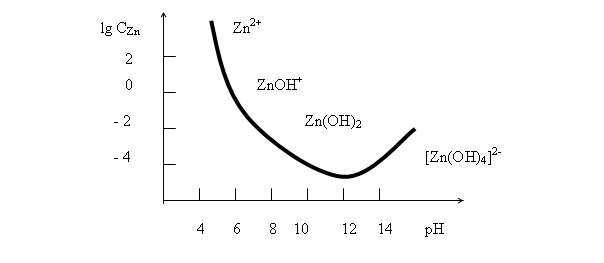
В качестве иллюстрации вышесказанного на рис.12 приведена кривая растворимости гидроксида цинка в координатах «логарифм концентрации цинка во всех его формах ![]() - рН раствора». На кривой ясно видны перегибы, соответствующие переходу от одних химических форм цинка к другим и те области рН, где эти формы являются доминирующими.
- рН раствора». На кривой ясно видны перегибы, соответствующие переходу от одних химических форм цинка к другим и те области рН, где эти формы являются доминирующими.
 .
.
Рис. 12. Зависимость логарифма концентрации цинка во всех его формах lgCZnот рН раствора
В заключение следует указать на то, что к приводимым в справочной литературе данным по произведениям растворимости малорастворимых гидроксидов металлов следует относиться с большой осторожностью. Дело в том, что гидроксиды, особенно содержащие две и более гидроксогруппы, имеют переменный состав, часто не имеющий ничего общего с той простейшей химической формулой, которая им приписывается. Так, белое студнеобразное вещество, выпадающее в осадок при постепенном добавлении щелочи к раствору соли алюминия, представляет собой соединение неопределенного состава и вовсе не отвечает формуле Al(OH)3, которой мы обычно пользуемся при написании уравнения соответствующей реакции. По сути дела это так называемый гидратированный оксид, связанный кроме того с переменным количеством гидроксогрупп ![]() . Более того, со временем или, как говорят, при старении этого осадка его состав существенно меняется. В то же время, во многих справочниках приводятся значения произведения растворимости Al(OH)3 (которые, впрочем, часто отличаются друг от друга).Понятно, что количественные расчеты, где применяются эти данные, нельзя считать достаточно достоверными, потому что они относятся к идеализированному по своему составу гидроксиду.
. Более того, со временем или, как говорят, при старении этого осадка его состав существенно меняется. В то же время, во многих справочниках приводятся значения произведения растворимости Al(OH)3 (которые, впрочем, часто отличаются друг от друга).Понятно, что количественные расчеты, где применяются эти данные, нельзя считать достаточно достоверными, потому что они относятся к идеализированному по своему составу гидроксиду.
Растворимость солей. В большинстве случаев малая растворимость в воде присуща солям слабых кислот. Так, подавляющее большинство сульфидов, карбонатов, оксалатов и т.д. являются практически нерастворимыми в воде соединениями.
Рассмотрим закономерности осаждения малорастворимых сульфидов двухзарядных катионов MS, т.к. это наиболее часто встречающаяся группа солей, широко применяемая в аналитической химии для разделения веществ.
Между осадком сульфида и его насыщенным раствором устанавливается равновесие
МS(т)![]() М2+(р) +S2-(р),
М2+(р) +S2-(р),
характеризуемое произведением растворимости
![]() (46)
(46)
Ионы ![]() в свою очередь участвуют в кислотно-основных равновесиях, присущих слабой двухосновной сероводородной кислоте:
в свою очередь участвуют в кислотно-основных равновесиях, присущих слабой двухосновной сероводородной кислоте:
![]() ,
,
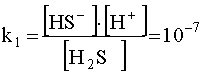 , (47)
, (47)
![]() ,
,
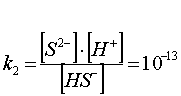 . (48)
. (48)
Растворимость S сульфида, равную равновесной концентрации катиона М2+ в насыщенном растворе, можно выразить через уравнение материального баланса, имея в виду, что [M2+] должна быть равна концентрации серы во всех ее формах:
Запишем уравнение материального баланса в виде
![]() .
.
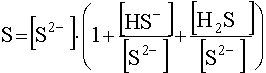 (49)
(49)
Из уравнения (46) получим:
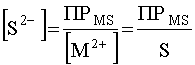 .
.
Из уравнения (48) вытекает:
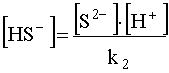 (50)
(50)
Второе слагаемое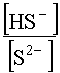 уравнения (49) после подстановки в него концентрации
уравнения (49) после подстановки в него концентрации![]() в форме (47) имеет вид
в форме (47) имеет вид
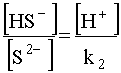 (51)
(51)
Концентрация недиссоциированных молекул H2S может быть выражена из уравнения (47):
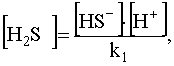 .
.
но поскольку из (51) следует, что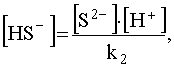 то
то
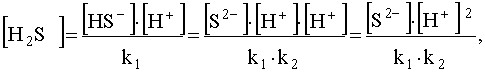 .
.
С учетом этих преобразований уравнение (49) можно представить
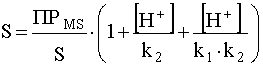 .
.
Отсюда выразим растворимость сульфида:
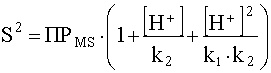 .
.
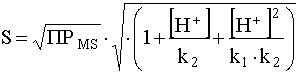 .
.
Учитывая, что ![]() ,
, ![]() а (уравнения (47) и (48)), запишем последнее уравнение в логарифмической форме:
а (уравнения (47) и (48)), запишем последнее уравнение в логарифмической форме:
![]() (52)
(52)
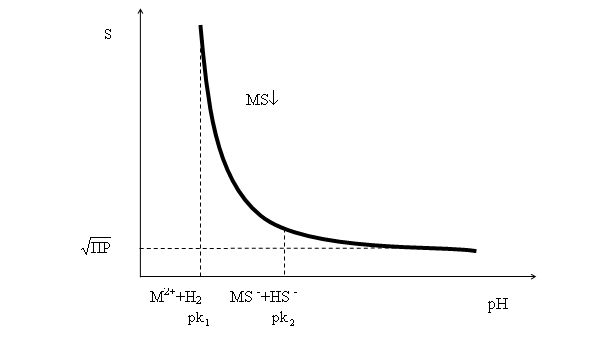
Из уравнения (52) непосредственно следует, что растворимость сульфидов тем больше, чем более кислой является среда раствора (чем меньше его рН). Рассмотрим некоторые частные случаи, вытекающие из уравнения (52).
а) рН > pk2. (щелочная среда). В такой ситуации экспоненциальные слагаемые в уравнении (52) значительно меньше единицы и ими можно пренебречь. Тогда ![]() , что соответствует минимальной растворимости сульфида.
, что соответствует минимальной растворимости сульфида.
б)рН = pk2В этом случае ![]() .
.
в)рН < pk2. Экспоненциальные слагаемые уравнения (52) значительно больше единицы. Растворимость резко снижается при уменьшении рН (рис. 13).
 .
.
Рис. 13 Зависимость растворимости сульфида двухвалентного металла MSот рН среды
В заключение отметим, что уравнение (52) справедливо не только для сульфидов типа MS, но и для любых малорастворимых солей двухвалентных металлов и двухосновных слабых кислот H2A,т.е. для таких солей, как карбонаты, сульфиты, хроматы, оксалаты и т.д.
