
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

СОЕДИНЕНИЯ АЗОТА В БИОМЕДИЦИНСКИХ НАУКАХ
Колосов А. Е., Жданова О. Б., Мартусевич А. К., Ашихмин С. П.,
Глава III. БИОКРИСТАЛЛОМНЫЕ ТЕХНОЛОГИИ В ИЗУЧЕНИИ БИОЛОГИЧЕСКИХ СВОЙСТВ АЗИДА НАТРИЯ
Исследование свойств различных дезинфектантов представляет значительный интерес для практики, тогда как большинство работ в этой области включают только микробиологические методы, а другие, не менее информативные подходы к их оценке подчас игнорируются. К таковым, в частности, могут быть причислены кристаллоскопические методы.
Попытки использования феномена кристаллизации, т.е. кристаллообразования при фазовом переходе «жидкость – твердое тело», в отношении различных веществ в фармакологии и фармации отмечаются уже с начала тридцатых годов XX века [2, 3]. В то же время приоритетной задачей, ставящейся в этих работах, являлась идентификация состава препаратов, что основывалось на предположении об особом характере образуемых ими кристаллов [3]. Однако необходимо заметить, что дегидратация отдельных (индивидуальных) веществ не всегда приводит к получению уникальной кристаллоскопической картины. Это заставляет исследователей обращаться к поиску новых способов расшифровки результатов теста на кристаллизацию. Определенным итогом изысканий явилось формирование в течение последних 30-35 лет нового научного направления – кристаллоскопических методов исследования, областью применения которых стала медицина, прежде всего судебная [13] и клиническая диагностика [2, 11, 14].
Предложен ряд теорий, позволявших с собственных позиций трактовать результаты кристаллообразования, в том числе теория «функциональной морфологии биологических жидкостей» академика В.Н. Шабалина и профессора С.Н. Шатохиной (2004) [14], теория кристаллизации белка «Протос» профессора Е.Г. Рапис (2003) [11] и некоторые другие, но каждая из них охватывает лишь отдельный аспект проблемы, тогда как интегративный подход в понимании природы, сущности и информационной емкости кристаллизации соединений органической и минерального происхождения до сих пор остаются нераскрытыми [2, 4, 5, 15]. Высказываются даже предположения кристаллообразовании как одном из связующих звеньев между живой и неживой материей [гипотеза о «феномене кристаллизации жизни» академика Н.П. Юшкина (1996) и работы Локтюшина А.А., Манакова А.В. (1996)].
Обращает на себя внимание вопрос о возможной роли кристаллоскопических подходов в оценке свойств различных объектов, таких как неорганические (соли, кислоты, щелочи) и биогенные субстанции (белки, жиры, моно- и полисахариды, вещества с более сложной органической структурой) [4, 6, 9, 15, 18].
Важным участком работы в этом направлении является экологическая составляющая, которая включает в себя, с одной стороны, экологию человека и диагностику его состояния с учетом действия экзогенных факторов, и, с другой стороны, экологический мониторинг окружающей среды и его объектов как непосредственно, так и во взаимосвязи живой и неживой природы, а также внутри биогеоценозов [15, 20]. Это подчеркивает значимость исследования взаимоотношений микро- и макромира, в том числе и в аспекте патогенности. Данный тезис выдвигает на первый план изучение средств и подходов, позволяющих сохранить баланс между аутохтонной, условно-патогенной и патогенной микрофлорой, что обеспечит исключительно симбиотический характер взаимодействия микро- и макроорганизмов в рассматриваемом биоценозе.
Нам представляется, что относительно изучаемой проблемы имеет смысл описывать следующий триумвират задач кристаллоскопического анализа (рис. 3.1). Кроме того, кристаллографический анализ может быть полезен как способ верификации качества самого дезинфектанта непосредственно перед использованием (см. рис. 3.1).
Данная схема уже частично применяется в отношении лекарственных препаратов. Для дезинфектантов подобные сведения в литературе практически отсутствуют, тогда как основной упор делается приведение состава и концентрации вещества к расчетным величинам.
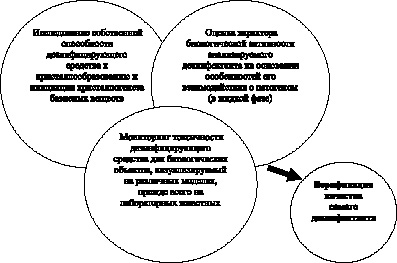
Рис. 3.1. Перспективы применения кристаллоскопического анализа в дезинфектологии
К наиболее значимым тенденциям развития дезинфектологии в настоящее время могут быть причислены нарастание ассортимента и эффективности современных дезинфицирующих средств. Однако повышение химической и/или биологической активности дезинфектантов, как правило, сопровождается параллельным ростом их токсичности. Данный факт требует проведения тщательных испытаний предлагаемого препарата для уточнения этой стороны его действия, с целью чего наиболее часто применяются различные биологические модели, прежде всего лабораторные животные [10, 20].
Значительный интерес представляет рассмотрение данной проблемы в ракурсе токсичности как механизма нарушения гомеостаза целостного организма, а, следовательно, и физико-химических свойств его биосубстратов. Принятие в расчет этого аспекта вопроса позволяет оценивать патогенное воздействие дезинфектанта косвенным путем – с помощью анализа кристаллообразующих и инициирующих свойств одной или нескольких биологических сред по значимому отклонению тезиокристаллоскопической картины от «паттерна», характерного для здорового организма [6, 7]. Это позволяет рассматривать наблюдаемые сдвиги в позиции теории адаптации к агенту или фактору.
Картина дегидратации раствора любого компонентного состава есть результирующая многочисленных параметров, наиболее значимыми из которых являются [1, 2, 12, 16, 18]:
1) непосредственно химическая структура основного вещества (или каждого из нескольких);
2) особенности подложки, на которой осуществляется высушивание образца (стекло, пластик и т.д.):
3) воздействующие факторы окружающей среды – элементы макроокружения (температура, влажность воздуха помещения, скорость и направление его потоков и другие);
4) информационная емкость растворителя (например, наличие и особенности водных кластеров) и характер его взаимодействия с растворенным в нем веществом.
С учетом многообразия приведенных выше факторов одним из наиболее важных является концентрация исходного раство-
ра [1, 2]. Данный параметр может не только способствовать изменению размеров частиц кристаллического и/или аморфного строения, но и играть роль в конфигурационных преобразованиях элементов и трансформации характера взаимодействий с микроокружением.
Несмотря на это, абсолютное большинство исследователей уделяют преимущественное внимание химическим свойствам препарата, тогда как его концентрация, имеющая, как показано выше, не меньшее значение, практически не учитывается [2, 9].
В то же время значимость оценки данного показателя подтверждается в работах, выполненных как in vitro, так и in vivo при моделировании процессов камнеобразования в мочевыделительной системе организма человека [16-19]. Авторами на примере оксалата кальция показана зависимость между исходной концентрацией литогенного соединения в растворе (или в биологической жидкости – моче) и частотой и интенсивностью рецидивирования мочекаменной болезни. Это обуславливает необходимость изучения взаимосвязи свободного и инициированного кристаллогенеза дезинфектанта с учетом его концентрации.
Целью исследования является изучение кристаллообразующих и инициирующих свойств, дезинфицирующей активности и токсичности нового средства (азида натрия).
Материал и методы исследования
В качестве анализируемого дезинфицирующего вещества нами были взяты образцы растворов азида натрия. Концентрация данных растворов составляла 0,1; 0,3 и 0,5 %.
Для оценки свойств нового дезинфицирующего средства параллельно производились микробиологические и кристаллоскопические исследования (рис. 3.2).
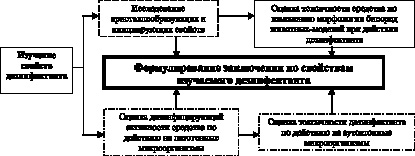
Рис. 3.2. Алгоритм совместного использования кристаллоскопических и микробиологических методов в оценке свойств дезинфектантов
Изучение дезинфицирующей активности азида натрия произведено путем оценки количества колоний тестовых патогенных микроорганизмов (Staphylococcus aureus, Enterobacter aerogenes, Bacillus anthracis) до и после воздействия дезинфектанта (время экспозиции со смесью микроорганизмов 10 минут), причем исходный уровень в дальнейших расчетах принимали за 100 %. Токсичность оценивалась с использованием аутохтонной микрофлоры (Escherichia Coli, Lactobacillus, Bifidobacterium). Чашки с посевами для выделения аэробных бактерий помещали в термостат и инкубировали при 37 °С в течение двух суток, для выделения анаэробных микроорганизмов использовали микроанаэростат с последующей инкубацией в аналогичных условиях в течение трех суток. После инкубации посевов все типы выросших колоний подсчитывали и микроскопировали. Идентификацию выделенных бактерий осуществляли общепринятыми методами.
Общая структура изучения токсичности представлена на рис. 3.3.
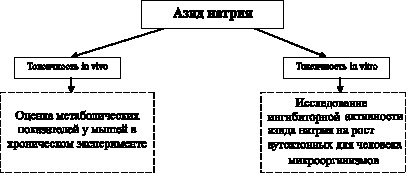
Рис. 3.3. Дизайн исследования токсичности формалина
Оценка токсичности препарата in vivo производилась на 12 исходно здоровых белых мышах. Методика эксперимента предусматривала нахождение животных в атмосфере паров раствора азида натрия, находящегося в той же камере и самостоятельно испаряющегося внутрь нее.
Длительность пребывания мышей в камере была постоянной и составляла 1 час в течение 30 дней подряд. В качестве основного материала для кристаллоскопического анализа были использована моча, собираемая в исходном состоянии (до начала эксперимента), а также сразу по окончании токсического воздействия на 3, 7, 14 и 30-е сутки (рис. 3.4).
В комплекс кристаллоскопических методов исследования вошли классическая кристаллоскопия, позволяющая установить особенности собственного кристаллообразования биосреды, а также дифференциальная тезиграфия, визуализирующая инициаторный потенциал биожидкости [2, 8]. Учет результатов собственного кристаллогенеза осуществлялся путем использования идентификационной таблицы кристаллических и аморфных образований, а также системы количественных и полуколичественных критериев [8].
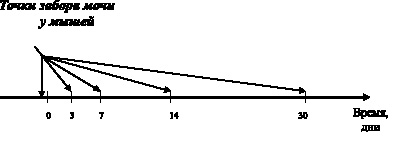
Рис. 3.4. Схема исследования токсичности азида натрия in vivo
Тезиграфический компонент оценивался путем нахождения значений системы основных и дополнительных показателей, характеризующих физико-химические свойства исследуемой биологической среды.
В целях более полного математического описания и моделирования кристаллообразования биосубстратов осуществлялся подсчет производных коэффициентов тезиокристаллоскопии [8, 9].
Статистическая обработка данных выполнялась в среде электронных таблиц Microsoft Excel 2007, а также программных пакетах SPSS 11.0 и Primer of biostatistics 4.03.
Результаты и их обсуждение
На основании микробиологических исследований показано, что препарат обладает достаточной антибактериальной активностью в отношении изученной патогенной микрофлоры, причем дезинфекционный потенциал нарастает с увеличением концентрации агента (рис. 3.5).
Дезинфицирующая активность азида натрия была сопоставлена с его токсичностью для аутохтонной микрофлоры (оценка in vitro) (рис. 3.5 и 3.6). Это позволило выделить оптимальную концентрацию дезинфектанта, которой оказался 0,3 % раствор азида натрия, обладающий достаточной дезинфицирующей активностью при допустимой токсичности. В связи с этим исследования токсичности in vivo (на лабораторных мышах) продолжены только с данной концентрацией.
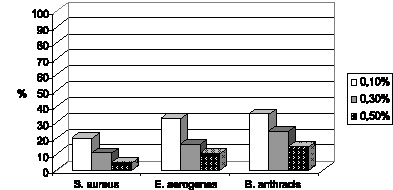
Рис. 3.5. Дезинфицирующая активность азида натрия в отношении различных патогенов (в % к количеству колоний интактного биоматериала)
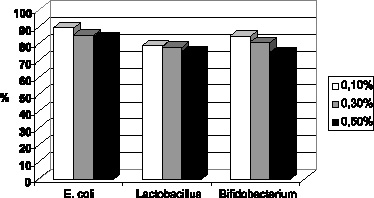
Рис. 3.6. Токсичность в отношении аутогенной флоры (в % к количеству колоний интактного биоматериала)
Результаты изучения собственного кристаллогенеза мочи мышей, включенных в хронический эксперимент с воздействием азида натрия, подтвердили низкую токсичность средства. Это продемонстрировано на примере степени деструкции фации – одного из наиболее показательных критериев нарушения гомеостаза биологической жидкости и организма в целом (рис. 3.7).
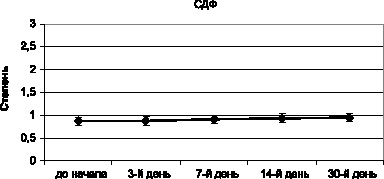
Рис. 3.7. Динамика степени деструкции кристаллоскопической фации мочи мышей в процессе хронического эксперимента
Данные тенденции нашли полное подтверждение при анализе равномерности распределения элементов кристаллоскопической фации (рис. 3.8). По этому показателю, как и по степени деструкции, не наблюдается достоверных различий даже между исходным состоянием и конечной точкой исследования (p > 0,05).
В отношении сравнительной тезиграфии было обнаружено достоверное повышение основного тезиграфического коэффициента Q на 7-й день эксперимента, что трактуется нами как адаптивная перестройка компонентного состава биожидкости, которая полностью нейтрализуется к 30-му дню (рис. 3.9). К этому сроку уровень данного критерия практически сравнивается с первоначальным (p > 0,05).
В целом установлено, что имеет место четкая зависимость между испытываемыми концентрациями водного раствора азида натрия и образуемой ими кристаллоскопической картиной. В частности, выявлено, что наиболее характерной кристаллической формой (морфотипом) для данного соединения является одиночно-кристаллическая структура типа «пирамида» (в пространственном варианте «гробовой крышки» – рис. 3.10). В то же время размеры данного элемента существенно варьируют с учетом микро- макроокружения. Кроме того, в абсолютном большинстве случаев (при многократном исследовании) в микропрепарате обнаруживались структуры с широко варьирующими габаритами.
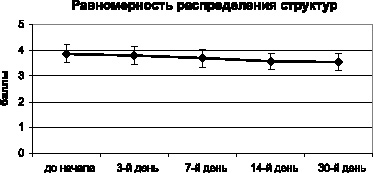
Рис. 3.8. Динамика равномерности распределения элементов по кристаллоскопической фации мочи мышей в процессе хронического эксперимента
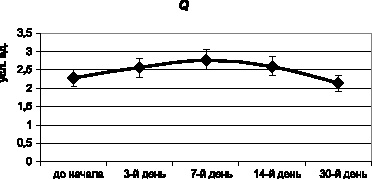
Рис. 3.9. Основной тезиграфический коэффициент Q мочи мышей в процессе хронического эксперимента

Рис. 3.10. Картина собственной кристаллизации азида натрия (ув. х56)
Так, при нарастании концентрации дезинфицирующего средства от 0,1 к 0,5 % водному раствору наблюдаются значительные сдвиги по параметрам:
1) доля крупных (агрегатных) структур;
2) перераспределение кристаллических элементов картины в сторону краевой зоны («латерализация фации»).
Сведения о фации, образуемой собственно самим дезинфектантом, могут быть использованы для идентификации средства с учетом его концентрации в растворе [7, 9].
Выводы
1. Предложенный комплексный алгоритм с параллельным применением микробиологических и кристаллоскопических методов может использоваться для изучения свойств различных дезинфектантов.
2. Азид натрия обладает выраженной дезинфицирующей активностью в отношении рассмотренных патогенных микроорганизмов, но малотоксичен относительно аутохтонной микрофлоры, а также в эксперименте in vivo.
3. Азид натрия при дегидратации способен образовывать фацию с постоянным компонентным составом, представленным одиночными кристаллами типа «пирамида», а также имеет четкий инициаторный потенциал в отношении различных базисных веществ, которые зависят от его исходной концентрации.
4. Определение кристаллоскопических особенностей дезинфицирующего средства может быть полезно при определении степени чистоты и соответствия его концентрации требуемым величинам.
Список литературы
1. Барер Г.М., Денисов А.Б., Михалева И.Н. с соавт. Кристаллизация ротовой жидкости. Состав и чистота поверхности подложки // Бюллетень экспериментальной биологии и медици-
ны. – 1998. – Т. 126, №12. – С. 693-696.
2. Воробьев А.В., Мартусевич А.К., Перетягин С.П. Кристаллогенез биологических жидкостей и субстратов в оценке состояния организма. Нижний Новгород: ФГУ «ННИИТО Росмедтехнологий», 2008. – 384 с.
3. Лобанов В.И. Микрокристаллоскопические реакции обнаружения некоторых производных барбитуровой кислоты // Журнал аналитической химии. – 1966. – №1. – С. 110.
4. Локтюшин А.А., Манаков А.В. Минералы и жизнь в голографической модели вещества // Тез. 2-го Международного семинара «Минералология и жизнь: биоминеральные взаимодействия». – Сыктывкар. – 1996. – С. 10-11.
5. Мартусевич А.К. Информационная физико-биохимическая теория кристаллизации как отражение морфологии биологических жидкостей // Бюллетень сибирской медицины. – 2005. –
Т. 4. – Приложение 1. – С. 185.
6. Мартусевич А.К. К методике изучения физиологической активности лекарственных средств кристаллографическими методами // Тез. докл. V научной конференции Института физиологии Коми НЦ УрО «Физиология человека и животных: от эксперимента к клинической практике». – Сыктывкар. – 2006. – С. 79-81.
7. Мартусевич А.К., Жданова О.Б. Метод тезиокристаллоскопии в идентификации качества лекарственного препарата // Фармация. – 2006. – №6. – С. 15-17.
8. Мартусевич А.К. Количественная оценка результата свободного и инициированного кристаллогенеза биологических субстратов. Учебное пособие. Нижний Новгород: ФГУ «ННИИТО Росмедтехнологий», 2008. – 28 с.
9. Мартусевич А.К., Гришина А.А., Камакин Н.Ф. Фармакобиокристалломика: современное состояние и перспективы // Молекулярная медицина. – 2010. – №4. – С. 22-25.
10. Перетягин С.П. с соавт. Лабораторные животные в экспериментальной медицине. Нижний Новгород: ФГУ «ННИИТО Росмедтехнологий», 2011. – 300 с.
11. Рапис Е.Г. Белок и жизнь. Самоорганизация, самосборка и симметрия наноструктурных супрамолекулярных пленок белка. М.: «МИЛТА – ПКП ГИТ», 2003. – 368с.
12. Тарасевич Ю.Ю., Константинов В.О., Аюпова А.К. Моделирование дендритного роста кристаллов соли в биологических жидкостях. // Известия вузов. Северо-Кавказский регион. Естественные науки. – 2001. – Спецвыпуск. Математическое моделирование. – С. 147- 149.
13. Тахер М.А. Ассад Судебно-медицинская диагностика прижизненного повешения по кристаллографической структуре биологических жидкостей: Автореф. … канд. мед. наук. – Киев,
1995. – 16 с.
14. Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. М.: Хризопраз, 2001. – 304 с.
15. Юшкин Н.П., Гаврилюк М.В., Голубев Е.А. Сингенез, взаимодействие и коэволюция живого и минерального миров: абиогенные и углеводородные кристаллы как модели протобиологических систем. Концепция кристаллизации жизни // Информационный бюллетень РФФИ. – 1996. – Т. 4. – С. 393.
16. Azoury R., Garside J., Robertson W. G. Calcium oxalate precipitation in a flow system: An attempt to stimulate in the early stages of stone formation in the renal tubules // J. Urol. – 1986. – Vol. 136, N 1. – P. 150-153.
17. Chernov A.A. Crystall growth and crystallography // Acta Crystallography. – 1998. – Vol. 54, N 1. – P. 859-872.
18. Jones W.T., Resnick M. The characterization of soluble matrix proteins in selected human renal calculi using two-dimensional poliacrylamide gel electrophoresis // J. Urology. – 1990. – Vol. 144,
N 4. – P. 1010-1014.
19. Lanzalaco A.C., Singh R.P., Senesco S.A. The influence of urinary macromolecules on calcium oxalate monohydrated crystal growth // J. Urol. – 1988. – Vol. 139. – N 1. – P. 190-195.
20. Martusevich A.K., Ghdanova O.B., Rasputin P.G., Koshkin A.N. Disinfectant activity and crystallogenesis features of the new agent taking in consideration its concentration // In.: Advanced disinfectants and safety techniques applied in pathogen treatment. Kirov: RPCEM RACEM Ltd, 2006. – P. 204-214.