
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.2.4. Ионный обмен и кислотность раствора
В этом случае на равновесие ионного обмена (58) накладывается равновесие с переносом протона (кислотно-основное), что может кардинально изменить конечный результат процесса.
Предположим, что катионит сульфонатного типа (сильнокислотный) в Н+-форме находится в соприкосновении с раствором, содержащим катионы Li+:
![]()
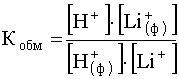 . (60)
. (60)
Равновесие (60) сдвинуто влево, т.к. катионы Н+ имеют бóльшее сродство к иониту, чем Li+ (см. ряд селективности для сильнокислотных катионитов).
Если же раствор содержит частицы, способные присоединять протон, т.е являющиеся основанием, то наряду с равновесием ионообмена, в жидкой фазе (раствор) установится кислотно-основное равновесие. Пусть литий был введен в раствор в виде ацетата. Тогда в растворе имеем равновесие:
![]()
![]() (61)
(61)
Таким образом, концентрация ионов водорода будет уменьшаться, в результате равновесие (60) начнет смещаться вправо, т.е. фиксированные катионитом ионы Н+ будут переходить в раствор, а их место будут занимать катионы лития.
Суммарное уравнение процесса, складывающееся из равновесий (60) и (61), имеет следующий вид:
![]() (62)
(62)
Чтобы оценить, насколько сильно это равновесие сдвинуто вправо, и, следовательно, насколько эффективной будет фиксация Li+ катионитом, необходимо вычислить константу равновесия процесса:
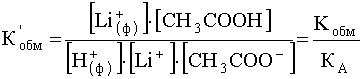 .
.
Это означает, ![]() что в 104,7 больше, чем
что в 104,7 больше, чем ![]() для равновесия (60), т.е. процесс (62) практически необратимо будет протекать в прямом направлении.
для равновесия (60), т.е. процесс (62) практически необратимо будет протекать в прямом направлении.
Возьмем другой пример.
Пусть имеется катионит в ![]() -форме, через который пропускается раствор, содержащий катионы Na+. Поскольку Na+ имеет меньшее сродство к катиониту, чем
-форме, через который пропускается раствор, содержащий катионы Na+. Поскольку Na+ имеет меньшее сродство к катиониту, чем ![]() , то равновесие
, то равновесие
![]()
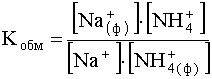 (63)
(63)
практически полностью сдвинуто влево. Однако если Na+ вводить в раствор в виде щелочи, то на равновесие (63) накладывается равновесие
![]()
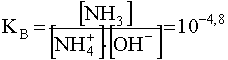 ,
,
из которого следует, что концентрация катионов аммония в растворе будет снижаться, что повлечет за собой десорбцию![]() с переходом их в раствор (равновесие (63) смещается вправо) с одновременной фиксацией Na+ на катионите. Суммарное равновесие выражается уравнением:
с переходом их в раствор (равновесие (63) смещается вправо) с одновременной фиксацией Na+ на катионите. Суммарное равновесие выражается уравнением:
![]()
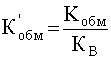 .
.
Здесь тоже, как и в предыдущем примере, константа равновесия суммарного процесса в 104,8 раза больше, чем ![]() для равновесия (63).
для равновесия (63).
Из изложенного следует практический вывод: чтобы повысить эффективность ионного обмена, следует удалять из раствора ионы, которыми был заряжен ионит перед проведением операции ионообмена.
