
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.2.5. Ионный обмен и комплексообразование
Конечный результат ионного обмена зависит от способности катионов, участвующих в процессе, к комплексообразованию.
Пусть через катионит в К+-форме пропускают раствор, содержащий ионы Fe3+, тогда равновесие
![]() (64)
(64)
практически полностью сдвинуто в прямом направлении, т.к. ионы Fe3+, имея достаточно высокий положительный заряд, обладают гораздо бóльшим сродством к катиониту, чем К+. Но если в раствор вводить анионы, образующие с Fe3+ достаточно прочные комплексы, то равновесие можно заставить протекать в обратном направлении. Так произойдет, если в растворе появляются ионы , которые связывают Fe3+ в прочный фторидный комплекс:
![]() . (65)
. (65)
По мере увеличения концентрации ионов фтора равновесие (65) все больше сдвигается вправо, так что вслед за первой ступенью комплекообразования будут протекать и последующие:
![]() и т.д.
и т.д.
В результате этого концентрация катионов Fe3+ в растворе понижается, что влечет за собой все больший сдвиг равновесия (64) влево – катионы Fe3+ будут в конечном итоге вытеснены из катионита, а их место займут ионы К+, т.е. произойдет кажущееся изменение селективности катионита по отношению к рассматриваемым катионам. При достаточной концентрации фторид-ионов в растворе образуется анионный комплекс ![]() , который можно вывести из раствора, пропуская его через слой анионита.
, который можно вывести из раствора, пропуская его через слой анионита.
Описанное явление инверсии селективности будет протекать тем полнее, чем прочнее образующийся в растворе комплекс.
Иногда с помощью ионного обмена удается выделить из раствора малоустойчивые комплексные частицы. Например, при постепенном добавлении к розовому раствору соли Со2+ ионов![]() происходит ступенчатое комплексобразование:
происходит ступенчатое комплексобразование:
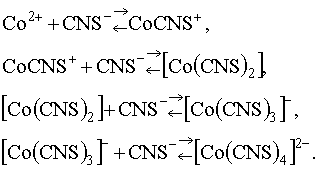 .
.
Последний комплекс ![]() имеет синюю окраску, но этот комплекс весьма неустойчив, и при разбавлении раствора окраска вновь становится розовой. Но указанный комплекс легко фиксируется анионитом, поэтому в контакте раствора с ним все указанные равновесия смещаются вправо вплоть до
имеет синюю окраску, но этот комплекс весьма неустойчив, и при разбавлении раствора окраска вновь становится розовой. Но указанный комплекс легко фиксируется анионитом, поэтому в контакте раствора с ним все указанные равновесия смещаются вправо вплоть до![]() , и поэтому анионит, адсорбируя этот малоустойчивый комплекс, окрашивается в синий цвет.
, и поэтому анионит, адсорбируя этот малоустойчивый комплекс, окрашивается в синий цвет.
Аналогичным образом можно закрепить на анионите и многие другие малоустойчивые анионные комплексы, например:
![]() .
.
На подобного рода равновесия можно влиять, соответствующим образом изменяя концентрацию лиганда в растворе, что иногда дает возможность зафиксировать на ионите промежуточные комплексы.
