
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.4.3. О роли активации процессов липопероксидации в механизмах развития цитолиза и дезинтеграции функциональных систем
Развитие прогрессирующей гипотонии, циркуляторной гипоксии, метаболического ацидоза, безусловно, приводят к деструктивным изменениям клеток различной морфо-функциональной организации в частности набуханию митохондрий и формированию тканевой гипоксии. Как известно, гипоксические состояния различного генеза являются инициирующим фактором образования активных форм кислорода и соответственно индукцией свободно-радикального окисления липидов в биологических мембранах клеток [1, 21, 25, 30].
К числу активных метаболитов кислорода, образуемых в зоне воспаления, относятся свободные радикалы, в частности, супероксидный анион-радикал, гидроксильный радикал, пергидроксил. Эти формы кислорода образуются, главным образом в митохондриях и микросомах клеток. Характерным для радикалов кислорода является их высокая реактогенность вследствие наличия на их внешней орбитали одного или нескольких непарных электронов. Источниками свободных радикалов в зоне воспаления служат: дыхательный взрыв фагоцитов при их стимуляции, каскад арахидоновой кислоты, ферментные процессы в эндоплазматическом ретикулуме и пероксисомах, митохондриях, цитозоле, а также самоокисление катехоламинов, лейкофлавинов, гидрохинонов.
Свободные радикалы взаимодействуют с различными субстратами клеток, особенно с липидными компонентами биологических мембран с образованием эндоперекисей.
Перекисное окисление липидов имеет место и в нормальных тканях, однако в очаге воспаления свободнорадикальные процессы значительно активируются [1, 19, 25].
При остром воспалении свободные радикалы вызывают разрушение межклеточного матрикса, оказывают повреждающее действие на фибробласты, в то же время они могут оказывать стимулирующее влияние на процессы пролиферации [25].
До настоящего момента остается, в значительной мере, не изученной роль свободнорадикальной дестабилизации биосистем в патогенезе ожогового шока и соответственно отсутствуют системные, патогенетически обоснованные принципы медикаментозной коррекции системных и метаболических сдвигов при тяжелой форме ожоговой болезни с использованием антиоксидантов, антигипоксантов, мембранопротекторов.
Целью настоящего фрагмента исследования явилось изучение характера и механизмов развития системных метаболических сдвигов в динамике ожоговой болезни, в частности при ожоговом шоке, установление роли свободнорадикальной дестабилизации биомембран клеток в патогенезе аутоинтоксикации при ожоговой болезни на основе результатов комплексного клинико-лабораторного обследования 30 больных с легкой и среднетяжелой формами ожоговой болезни в динамике патологии, находившимся на стационарном лечении в Саратовском центре термических поражений в период 2006–2010 гг.
Оценка тяжести ожоговой травмы проводилась традиционными методами, включающими определение площади ожоговой поверхности, глубины ожога, индекса Франка, индекса тяжести поражения. В соответствии с общепринятыми принципами классификации тяжести ожоговой травмы при ожоге занимающем 10–20 % поверхности тела, отмечается легкое течение ожоговой болезни, при повреждении 40 % поверхности имеет место средняя степень тяжести патологии [6, 14, 18, 19].
Ожоговая травма у наблюдаемого контингента больных характеризовалась развитием ожогового шока в течение первых 2–3-х суток с момента воздействия термического фактора, острой токсемии развивающейся с 4-х суток до начала отторжения струпа на 10–15-е сутки заболевания, септикотоксемии берущей начало от момента отторжения струпа до полного очищения раны и развития грануляционной ткани, и наконец, реконвалесценции характеризующейся заживлением ожоговой раны восстановлением соматического статуса организма [6, 18, 19].
Оценка системных метаболических сдвигов при ожоговой болезни проведена в соответствии с динамическим исследованием белкового спектра крови, состояния липопероксидации, степени выраженности аутоинтоксикации. В этих целях исследовали содержание в крови пациентов альбуминов, глобулинов, фибриногена, С-реактивного белка и продуктов липопероксидации [15].
О состоянии процессов липопероксидации судили по показателям содержания в эритроцитах и плазме крови диеновых конъюгатов (ДК) и малонового диальдегида (МДА). В качестве интегративного показателя стабильности биологических мембран использовано определение перекисной резистентности эритроцитов (ПРЭ), а также определение активности сывороточных трансаминаз [23, 24].
Показателями для оценки состояния антиоксидантной системы крови служили активность супероксиддисмутазы (СОД), каталазы, уровнь витамина Е, SH-групп, которые определялись общепринятыми спектрофотометрическими методами исследования [13, 25, 31].
Для оценки степени выраженности аутоинтоксикации использовали определение в крови молекул средней массы (МСМ) [11].
Определение количества эритроцитов в крови проводилось с использованием аппарата Sismex К-1000, позволяющего определить не только общее содержание эритроцитов, но и их средний объем (MCV), среднее содержание гемоглобина в одном эритроците (MCH), среднюю концентрацию гемоглобина в эритроцитах (MCHC).
Первый забор крови для исследования производился в момент поступления больного в ожоговый центр, второй – на 3-и сутки заболевания (период ожогового шока), третий забор осуществлялся на 10-е сутки (период ожоговой токсемии), четвертый – на 15-е сутки (стадия септикотоксемии) и, наконец, пятый забор крови – на 25-е сутки (период выздоравления) [6, 14, 18, 19].
Как показали результаты проведенных нами исследований, в первые сутки с момента развития ожоговой болезни на фоне ожогового шока, отмечались развитие эритроцитоза и резкое нарастание показателей гематокрита (р < 0,001) как следствие большой плазмопотери и сгущения крови, а также повышение абсолютного содержания гемоглобина в одном эритроците и увеличение среднего объема эритроцита (рис. 2.1–2.4).
Одновременно имели место сдвиги белкового спектра крови, характеризующиеся развитием гипоальбуминемии (р < 0,001), возрастанием в крови уровня острофазных белков (С-реактивного белка и фибриногена). Обнаруженное нами укорение СОЭ (р < 0,001) в указанный период наблюдения, безусловно было следствием выявленного нами изменения альбуминово-глобулинового соотношения и уменьшения гидратной оболочки вокруг эритроцитов, усиления их агрегации.
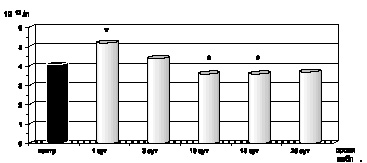
Рис. 2.1. Динамика изменения количества эритроцитов периферической крови у больных с ожоговой болезнью:
* – p < 0,001 (p – рассчитано по отношению к контролю)
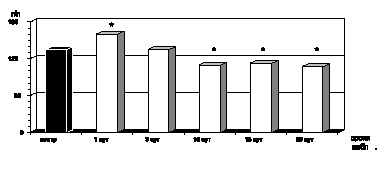
Рис. 2.2. Динамика изменения содержания гемоглобина в крови у больных с ожоговой болезнью:
* – p < 0,001 (p – рассчитано по отношению к контролю)
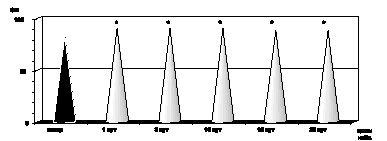
Рис. 2.3. Динамика изменения среднего объема эритроцита в крови больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю)
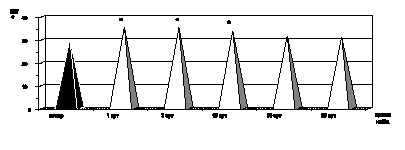
Рис. 2.4. Динамика изменения среднего содержания гемоглобина в 1-м эритроците у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю)
Развитие шокового синдрома у наблюдаемого контингента больных, как известно, сопровождается выраженной циркуляторной гипоксией, избыточным образованием активных форм кислорода и, соответственно, является инициирующим фактором активации процессов липопероксидации, свободнорадикальной дестабилизации биологических мембран клеток. Об этом свидетельствовало резкое увеличение уровня МДА (р < 0,001) и ДК (р < 0,001) в эритроцитах и плазме крови по сравнению с таковыми показателями контрольной группы (рис. 2.5–2.6). Избыточное накопление промежуточных продуктов липопероксидации сочеталось с недостаточностью механизмов антиоксидантной защиты клеток крови, на что указывало подавление активности СОД (р < 0,001) и каталазы эритроцитов (р < 0,001), снижение уровня витамина Е в сыворотке крови (р < 0,001), а также снижение содержания общих SH-групп крови (р < 0,001) по сравнению с таковыми показателями в условиях нормы (рис. 2.9–2.12).
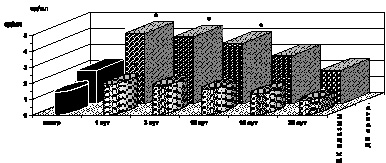
Рис. 2.5. Динамика изменения ДК эритроцитов и плазмы крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю); p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
Активация процессов липопероксидации в первые сутки развития ожогового шока и недостаточность антирадикальной защиты клеток закономерно сочетались с развитием синдрома цитолиза. Об этом свидетельствовали повышение активности сывороточных трансаминаз (АСТ (р < 0,001) и АЛТ (р < 0,001)) и снижение ПРЭ (р < 0,001) (рис. 2.8).
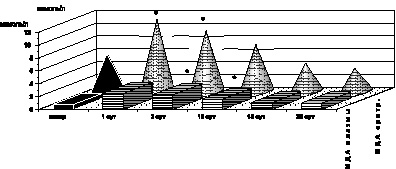
Рис. 2.6. Динамика изменения МДА эритроцитов и плазмы крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
Таким образом, развитие ожогового шока характеризуется формированием стереотипных сдвигов белкового спектра крови в виде диспротеинемии, эритроцитоза, ускорения СОЭ, синдромов цитолиза и аутоинтоксикации. Одним из ведущих патогенетических факторов дестабилизации биологических мембран клеток в период ожогового шока является активация процессов липопероксидации, обусловленная недостаточностью ферментного и неферментного звеньев антирадикальной защиты клеток различной морфофункциональной организации.
Спустя 3-е суток на фоне стабильно тяжелой клинической картины ожоговой болезни и адекватной корригирующей инфузионной терапии, направленной на восстановление гемодинамики и микроциркуляции, наблюдалась постепенная смена эритроцитоза, имеющего место в момент поступления больного в стационар, нормализацией количества эритроцитов, что было связано с ятрогенной гемодилюцией (рис. 2.1). Однако в этот период сохранялись гипоальбуминемия (р < 0,001), гиперглобулинемия (р < 0,001) и диспротеинемия (р < 0,001), отмечено дальнейшее увеличение СОЭ (р < 0,001) по сравнению с показателями контроля и показателями первых суток наблюдения.
В эти же сроки развития ожоговой болезни сохранялась интенсификация процессов липопероксидации, однако, уровень промежуточных продуктов липопероксидации: МДА (р < 0,001) и ДК (р < 0,001) в эритроцитах и плазме крови оставался достаточно высоким по отношению к показателям контроля, в то же время наблюдалось снижение данных показателей (р < 0,001) по сравнению с соответствующими величинами 1-х суток наблюдения (рис. 2.3, 2.4). В этот же период наблюдения сохранялась и недостаточность антирадикальной системы, о чем свидетельствовало понижение активности СОД (р < 0,001) и каталазы эритроцитов (р < 0,001) по сравнению с таковыми показателями в контрольной группе наблюдения (рис. 2.7, 2.8). Маркерами системного цитолиза клеток и выраженности аутоинтоксикации, характерными и для этой стадии ожоговой болезни, являлись снижение ПРЭ и прогрессирующая активация сывороточных трансаминаз (АСТ, р < 0,001; и АЛТ, р < 0,001) и возрастание уровня в крови МСМ (рис. 2.7, 2.8).
Таким образом, в динамике шокового синдрома на 1-е и 3-и сутки наблюдения отмечалась последовательная смена эритроцитоза нормализацией содержания эритроцитов в периферической крови как показателя адекватной инфузионной терапии. Между тем, максимально выраженные клинические проявления ожоговой болезни коррелировали со стабилизацией процессов липопероксидации, недостаточностью антиоксидантной системы крови, развитием синдромов цитолиза, аутоинтоксикации и диспротеинемии.
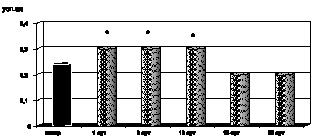
Рис. 2.7. Динамика изменения содержания МСМ в крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
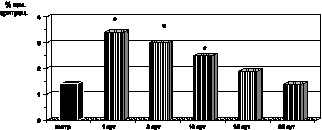
Рис. 2.8. Динамика изменения содержания ПРЭ в крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
Таким образом, в динамике шокового синдрома на 1-е и 3-и сутки наблюдения отмечалась последовательная смена эритроцитоза нормализацией содержания эритроцитов в периферической крови как показателя адекватной инфузионной терапии. Между тем, максимально выраженные клинические проявления ожоговой болезни коррелировали со стабилизацией процессов липопероксидации, недостаточностью антиоксидантной системы крови, развитием синдромов цитолиза, аутоинтоксикации и диспротеинемии.
Последующие наблюдения были проведены на 10-е сутки с момента поступления больных в стационар. Этот период соответствовал ожоговой токсемии, обусловленной образованием в зоне ожоговой травмы специфических токсинов (белковая фракция 0,43, очищенный токсический фактор, липопротеид с токсическими свойствами и т.д.), биологически активных веществ клеточного и гуморального происхождения и их резорбцией в системный кровоток [6, 18, 19].
Между тем, максимально выраженные клинические проявления ожоговой болезни коррелировали со стабилизацией процессов липопероксидации, недостаточностью антиоксидантной системы крови, развитием синдромов цитолиза, аутоинтоксикации и диспротеинемии.
Клинически ожоговая токсемия проявлялась развитием гнойно-резорбтивной лихорадки с повышением температуры до 40 °С, усилением аутоинтоксикации, на что указывало обнаруженное нами повышение содержания в крови МСМ (р < 0,001), а также появление психических расстройств, характеризующихся нарушением сна, дезориентацией, бредом (рис. 2.7). Как оказалось, в этот период ожоговой болезни развивалась нормохромная анемия на фоне стабильного увеличения качественных показателей эритроцитов: MCV (р < 0,001), MCHC (р < 0,001) и МСН (р < 0,001) (рис. 2.1–2.4). Одновременно имели место гипоальбуминемия (р < 0,001), стабильно высокий уровнь острофазных белков (р < 0,001), укорение СОЭ (р < 0,001) по отношению к показателям контроля, а также выраженная интенсификация процессов липопероксидации.
При этом показатели содержания ДК (р < 0,001) и МДА (р < 0,001) в эритроцитах значительно превышали соответствующие контрольные величины, в то же время заметно снижаясь по сравнению с таковыми параметрами на 1-е сутки поступления больных в стационар, то есть в период тяжелой клинической картины шокового синдрома (рис. 2.5, 2.6). В эти же сроки ожоговой болезни (то есть на 10 сутки с момента поступления в стационар) несколько возрастала ПРЭ по сравнению с таковыми показателями в 1-е сутки наблюдения (рис. 2.8), о чем свидетельствовало снижение процента гемолиза эритроцитов (р < 0,001), коррелирующее с относительным снижением уровня МДА и ДК в эритроцитах. Уровень активности сывороточных трансаминаз (АСТ (р < 0,001) и АЛТ (р < 0,001)) оставался по прежнему высоким.
Следует отметить, что на 10-е сутки с момента ожога сохранялась и недостаточность антиоксидантной системы крови: уровень активности каталазы (р < 0,02) и СОД (р < 0,001) эритроцитов был значительно ниже по сравнению с контрольными величинами, в то же время превышал соответствующие показатели активности антирадикальной системы эритроцитов на 1-е сутки развития ожогового шока (рис. 2.9, 2.10].
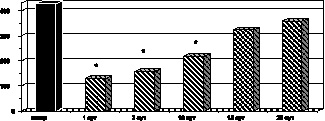
Рис. 2.9. Динамика изменения СОД цельной крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
К 15-м суткам с момента воздействия термического фактора отмечалась положительная динамика клинических проявлений ожоговой болезни: происходило очищение ожоговой раны от некротизированных тканей, активно формировались грануляции в зоне травмы, стабилизировалось психоэмоциональное состояние больного, снижался уровень аутоинтоксикации и, соответственно, содержание в крови МСМ достигало показателей контрольной нормы (р > 0,05). На этом этапе развития ожоговой болезни, как и в предыдущий период наблюдения, сохранялась нормохромная анемия (р < 0,001) на фоне стабильного увеличения размера эритроцита (р < 0,001), величины СОЭ (р < 0,001), гипоальбуминемии (р < 0,001) и диспротеинемии (р < 0,001) (рис. 2.1–2.4).
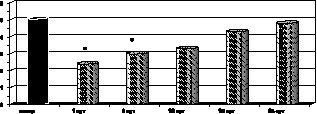
Рис. 2.10. Динамика изменения каталазы эритроцитов у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
Положительная динамика клинических проявлений ожоговой болезни коррелировала со значительным снижением интенсивности процессов липопероксидации по сравнению с предыдущими периодами наблюдения, на что указывала нормализация содержания МДА и ДК в эритроцитах, а также ДК в плазме крови (рис. 2.5, 2.6).
В связи с этим вполне закономерно, что выявленное нами подавление интенсификации процессов липопероксидации на 15-е сутки патологии коррелировало с повышением активности СОД (р < 0,001) и кататалазы эритроцитов (р < 0,001) по сравнению с показателями 1-х суток наблюдения, со снижением ПРЭ, однако нормализации указанных показателей не возникало (рис. 2.9, 2.10).
Последнее наблюдение было проведено спустя 25 суток с момента развития ожоговой травмы, причем для обследования была отобрана группа пациентов с положительной клинической динамикой, когда возникала эпителизация зоны ожога и общее улучшение соматического статуса, снижение степени аутоинтоксикации и соответственно нормализация уровня МСМ (р > 0,05) (рис. 2.7).
Как оказалось, в этот период наблюдения был обнаружен параллелизм между улучшением общесоматического статуса больных, активацией процессов репаративной регенерации в зоне термической травмы и заметным снижением в крови содержания промежуточных продуктов липопероксидации по сравнению с таковыми показателями предшествующих периодов наблюдения. Причем, отмечалась нормализация уровней МДА плазмы крови (р > 0,05) и ДК эритроцитов (р > 0,05) (рис. 2.5, 2.6).
Как оказалось, в этот период наблюдения был обнаружен параллелизм между одним из патогенетических факторов нормализации уровня промежуточных продуктов липопероксидации в крови пациентов с ожоговой травмой в указанный период наблюдения явилась активация ферментного и неферментного звеньев антиоксидантной системы крови. Так, активность каталазы эритроцитов (р > 0,5), СОД (р < 0,1) и показатели ПРЭ (р > 0,5) возрастали до контрольных величин. Однако содержание витамина Е в сыворотке крови (р < 0,001) и уровень SH-групп (р < 0,02) были выше соответствующих показателей предыдущих периодов наблюдения, но не достигали контрольных величин (рис. 2.8– 2.12).
В указанный период наблюдения сохранялись качественные и количественные сдвиги показателей периферической крови, в частности, нормохромная анемия, увеличение среднего размера эритроцитов по сравнению с показателями контроля, ускорение СОЭ, гипоальбуминемия и диспротеинемия.
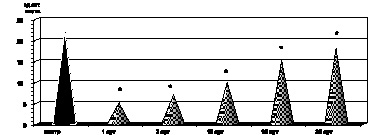
Рис. 2.11. Динамика изменения витамина Е в сыворотке крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
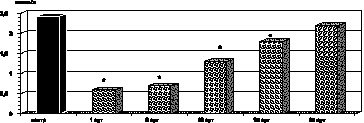
Рис. 2.12. Динамика изменения содержания SH-групп в крови у больных с ожоговой болезнью:
* – p < 0,001 (p рассчитано по отношению к контролю);
p1 < 0,001 (p рассчитано по отношению к 1-м сут наблюдения)
Выводы
1. Развитие ожоговой болезни легкой и средней степени тяжести характеризуется не только локальными стереотипными альтеративно-некротическими сдвигами в зоне действия термической травмы, но и формированием синдрома системного воспалительного ответа уже в ранние сроки патологии, характеризующегося такими классиче6нскими проявлениями, как лихорадочная реакция, тахикардия, нарушение внешнего дыхания, гипоальбуминемия, диспротеинемия, увеличение содержания в крови острофазных белков, ускорение СОЭ, аутоинтоксикация и, соответственно, накопление в крови МСМ.
2. Результаты проведенных исследований позволяют расширить существующие традиционные представления о характере функциональных и метаболических расстройств, свойственных синдрому системного воспалительного ответа при ожоговой травме. Развитие ожоговой болезни характеризуется закономерной активацией процессов липопероксидации и недостаточностью антиоксидантной системы крови, коррелирующих с тяжестью клинических проявлений патологии. Последнее свидетельствует о целесообразности включения в комплексную терапию ожоговой болезни антиоксидантов и антигипоксантов не только локального, но и системного действия.
3. В качестве объективных критериев оценки системных метаболических сдвигов при ожоговой болезни, оценки тяжести ее течения и эффективности ее комплексной терапии могут быть использованы показатели содержания в крови МДА, ДК, МСМ, ПРЭ, SH-групп, каталазы эритроцитов, СОД цельной крови. Установление патогенетической взаимосвязи количественных и качественных изменений эритроцитов, сдвигов белкового спектра крови с тяжестью клинических проявлений ожоговой болезни позволяет рекомендовать мониторинг их количественных и качественных сдвигов, а также белкового спектра крови для оценки эффективности терапии и прогнозирования течения заболевания.
Указатель основной литературы
-
Активация свободнорадикального окисления – эфферентное звено типовых патологических процессов /Н.П. Чеснокова, Е.В. Понукалина, М.Н. Бизенкова и др. – Саратов: Изд-во СМУ, 2006. – С. 20–24.
-
Алексеев А.А., Лавров В.А.,//Российский медицинский журнал. – 1998. –№1. – С. 41–44.
-
Алексеев А.А. Актуальные вопросы организации и состояния медицинской помощи пострадавшим от ожогов в Российской Федерации/А.А. Алексеев, В.А. Лавров //II съезд комбустиологов России: Сборник научных трудов-М.,2008. – С.3–5.
-
Бережная Н.М. //Цитокины и воспаление. – 2007. – Т.6. – №2–С.26–34.
-
Демьянов А.В., Котов А.Ю. //Цитокины и воспаление. – 2003. – №3–С.20–35.
-
Дмитриев Г.И., Воробьев А.В., Перетягин С.П. //II съезд комбустиологов России: Сборник научных трудов-М.,2008. – С.17–19.
-
Ершов Ф.И., Наровлянский А.Н., Мезенцева М.В. //Цитокины и воспаление. – 2004. – Т.3. – №1-С.3–6.
-
Зайчик А.Ш., Чурилов Л.П. Основы общей патологии. Часть I. / А. Ш. Зайчик, Л.П. Чурилов. – СПб.: ЭЛБИ, 2001. – 620с.
-
Кетлинский С.А. Цитокины и их антагонисты: теория и практика/С.А. Кетлинский, А.М. Ищенко//Медицинская иммунология. – 1999. – Т.1. – №3–4. – С.16.
-
Клячкин Л.М. //Клиническая медицина. – 1991. – Т.69, № 5. – С.44–49.
-
Ковалевский А.Н.//Лабораторное дело. – 1989. – №10. – С.35–39.
-
Ковальчук Л.В. //Иммунология. – 1998. – №6. – С.17–18.
-
Королюк М.А.//Лабораторное дело. – 1988. – №1. – С.16.
-
Лавров В.А., Виноградов В.Л.//Комбустиология. – 2000. – №2. – С.1–9.111(о.шок)
-
Лукичева Т.И.//Лабораторное дело. – 1978. – №4. – С.227–233.
-
Медуницин Н.В. //Российская иммунология. – 1999. – №4. – С.234–236.
-
Моженок Т.П., Булычев А.Г., Браун А.Д. //Вопр. Мед. химии. – 1990. – №6, С. 11–13.
-
Неотложная помощь при термической травме / Н.В. Островский, В.Б. Бабкин, И.Б. Белянина и др. – Саратов: Изд-во СМУ, 2006. – 35с.
-
Ожоги. Руководство для врачей / Б.С. Вихреева, В.М. Бурмистрова. – Ленинград: «Медицина», 1986. – 270 с.
-
Патофизиология / П.Ф. Литвицкий. – Москва: Изд-во «ГЭОТАР – Медиа», 2008. – С.66–69.
-
Понукалина Е.В., Афанасьева Г.А. // Актуальные проблемы патофизиологии: Мат-лы науч. конф. – СПб., 1999. – с.11–12.
-
Симбирцев А.С. //Цитокины и воспаление. – 2004. – Т.3. – №2. – С.16–22.
-
Стальная И.Д.Современные методы в биохимии-М.: Москва.1977. – С.66–68.
-
Суплонов С.Н. //Лабораторное дело. – 1986. – №8. – С.459–463.
-
Типовые патологические процессы / Н.П. Чеснокова. – Саратов: Изд-во СМУ, 2004. – 400 с.
-
Титов В.Н. //Клиническая лабораторная диагностика. – 2003. – №12. – С.3–12.
-
Шанин В.Ю. Типовые патологические процессы. – СПб.,1996.
-
Шубин М.Г., Авдеева М.Г.// Архив патологии. – 1997. – №7. – С.3–8.
-
Яровая Г.А., Коровина Н.Н., Магомедова М.Г.//Вопр.мед.химии. – 1994. – Т. 40., №3. – С. 16–18.
-
Choi D.V. Leninger-Muller B., Wellman M., et al. // J. Toxicoi. Environ.Health A. – 2004. – Vol.67. – P. 2061–2071.
-
Fried R. Enzymatic and new- enzymatic assay of superoxide dismutase/R. Fried Fried//Biochemie. – 1975. – Vol.57. – P.675–680.
