
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
1.2.4. Кинетические закономерности топохимических реакций
Во всех рассмотренных выше случаях процесс образования структуры шпинели сводится к получению оксидов соответствующих металлов и далее – химическому взаимодействию компонентов. В свою очередь, химическое взаимодействие в смеси кристаллических реагентов обладает особенностью: оно имеет гетерогенный характер, т.е. протекает на поверхности раздела сосуществующих фаз.
Как известно [63], топохимической называется гетерогенная реакция, в которой участвует по крайней мере одно твердое исходное вещество и образуется не менее одного твердого продукта реакции. Твердофазная реакция является частным случаем топохимической. Условно к твердофазному синтезу принято относить процесс, проходящий без заметного участия жидкой и газовой фаз [64].
Химические и физико-химические превращения в смеси твердых веществ являются сложным и многостадийным процессом. Выделяют [64] следующие основные его стадии:
? возникновение дефектов, разрыхление кристаллических решеток исходных веществ;
? перестройка кристаллических решеток вследствие полиморфных превращений;
? образование и распад твердых растворов;
? диффузия (поверхностная, внутренняя, внешняя);
? спекание;
? рекристаллизация;
? возгонка;
? диссоциация;
? собственно химическое взаимодействие.
В ходе твердофазной реакции часть перечисленных процессов является обязательной стадией (например, диффузия, химическое взаимодействие), некоторые могут сопутствовать ей как параллельные или вообще не иметь места.
Период активного изучения механизма твердофазных реакций приходится на начало ХХ столетия. Тогда Г. Тамман и И. Хедвалл с сотрудниками [65, 66] сформулировали следующие положения о специфических закономерностях протекания реакций в смесях кристаллических веществ:
1. Реакции, протекающие в смесях кристаллических тел при нагревании, осуществляются непосредственно между зернами этих тел; роль жидких и газообразных веществ в этих процессах несущественна.
2. Реакция между твердыми веществами идет с выделением тепла.
3. Достижение равновесия в системах, не содержащих твердых растворов, практически невозможно.
4. Температура начала реакции соответствует температуре интенсивного обмена местами элементов кристаллических решеток реагирующих веществ или температуре начала их спекания.
5. В случае полиморфного превращения одного из компонентов смеси при относительно низкой температуре (ниже температуры реакции в отсутствии такого превращения) химическая реакция начинается и интенсивно протекает в точке этого полиморфного превращения.
В [67] на примере реакции образования алюмината магния («благородной шпинели») MgO + Al2O3 = MgAl2O4 показана существенная роль физико-химического состояния реагентов. Так, если взять в качестве исходной ?-модификацию Al2O3, то реакция проходит только при температуре 1500 °С; используя в качестве исходного вещества ?-Al2O3, процесс удается провести при температуре до 1300 °С (эффект Хедвалла).
В кристаллах реальных порошков в условиях термодинамического равновесия не все узлы кристаллической решетки заняты атомами [68, 69]. В структуре имеются вакансии, что делает возможным протекание диффузии (по так называемому вакансионному механизму). Как известно, диффузия – самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации [70]. В случае кристаллов диффузия осуществляется так, что диффундирующая частица движется в определенном направлении путем перескоков в вакантные места решетки; этот же процесс можно рассматривать как дрейф вакансий в противоположном направлении.
В зависимости от пути миграции диффундирующих частиц (атомов, молекул, ионов) различают поверхностную (по внешней поверхности), диффузию вдоль граней кристалла и объемную диффузию (в глубине решетки). Поверхностная диффузия обеспечивает наибольшую скорость твердофазной реакции. Для поликристаллических материалов выделяют внешнюю (между поверхностями зерен) и внутреннюю (в зернах) диффузии.
Пространственное распределение вещества в случае твердофазного процесса протекает по вакантным местам кристаллической решетки. Поэтому спекание кристаллических порошков в отсутствии жидкой и газовой фаз зависит от концентрации дефектов.
Теория твердофазных реакций была существенно развита К. Вагнером [71], а позднее – Г. Шмальцридом [72]. Согласно положениям этой теории, диффузия, а, соответственно, и реакции в твердых телах, осуществляются в основном за счет подвижности ионов и электронов, обусловленной неравновесным состоянием решетки. Основные положения этой теории могут быть сформулированы следующим образом:
– скорость реакции лимитируется диффузией ионов через слой образующегося продукта;
– слой продукта реакции является компактным, содержащиеся в нем неравновесные дефекты (дислокации, границы зерен) не вносят определяющего вклада в подвижность ионов;
– реакции на границе фаз протекают значительно быстрее, чем процессы диффузии через слой продукта, поэтому на границах фаз устанавливается локальное термодинамическое равновесие;
– отдельные ионы движутся в реакционном слое назависимо друг от друга, в любом поперечном сечении продукта сохраняется условие электронейтральности.
Оценить подвижность ионов можно на основе следующих общих положений:
? при равных зарядах (валентностях) более подвижным оказывается положительный ион;
? при различных зарядах одного знака более подвижен ион с меньшим зарядом;
? при прочих равных условиях подвижность иона увеличивается с уменьшением его радиуса;
? при повышении температуры подвижность ионов увеличивается.
Наиболее типичные схемы массопереноса для реакции АО + В2О3 = АВ2О4 представлены на рис. 1.2 [67].
В первом случае (рис 1.2, а) наиболее подвижными в слое продукта являются ионы А2+ и О2–; они переносятся в эквивалентных количествах к границе раздела АВ2О4–В2О3 и взаимодействуют там с образованием продукта. Во втором случае (рис. 1.2, б) более подвижные ионы В3+ и О2– взаимодействуют, проходя через слой продукта к границе
АО-АВ2О4. Наконец, в третьем случае (рис. 1.2, в) образование продукта реакции происходит на обеих границах в результате противодиффузии катионов.
При расчете коэффициента диффузии D в [73] была предложена формула:
x2 = 4D?, (1.1)
где x – толщина слоя образовавшегося продукта, см; D – коэффициент диффузии, см2/с; ? – время, с.
В этом случае авторы предположили, что процесс диффузии катионов протекает также как и при диффузии в полубесконечную среду.
В [67] приводится соотношение для расчета коэффициента диффузии, учитывающее изменение плотности продукта реакции по сравнению с исходным веществом:
x2 = 2Dv?, (1.2)
где v – относительное увеличение объема продукта реакции при переносе одного моль ионов.
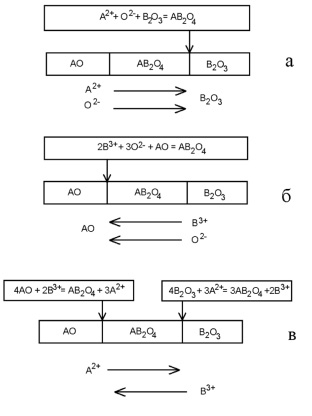
Рис. 1.2. Схемы массопереноса в реакции АО + В2О3 = АВ2О4
Температурная зависимость коэффициента диффузии выражается известным уравнением, аналогичным уравнению Аррениуса [68]:
D = D0exp(–Q/(RT)), (1.3)
где D0 – так называемый температурно независящий фактор, который формально равен коэффициенту диффузии при Т > ?, см2/с; R – универсальная газовая постоянная, Дж/(моль.К); T – температура, К.
Механизм образования шпинелей рассмотрен в [23, 74–78]. В [74] на примере системы FeO–MgО–Fe2O3 изучен механизм диффузии катионов. Отмечено, что диффундирующим ионом является Fe2 + , в оксиде магния ионы железа перемещаются медленней, чем в феррите магния, и при 1300 °С значения коэффициента диффузии железа в оксиде магния составляет 1,29•10–9 см2/с, а в феррите магния – 5,58•10–8 см2/с.
Образование никель-цинкового и марганец-цинкового ферритов рассмотрено в [75]. Отмечено, что при 850 °С образование твердого раствора NixZn1–xFe2O4 идет в три стадии. На первой стадии образуется феррит цинка, при этом остаются в свободном состоянии часть NiO и Fe2O3. На второй стадии образуются ферриты с избыточным против стехиометрии содержанием никеля. Одновременно начинается процесс встраивания ионов Ni2+ в решетку ZnFe2O4. На третьей стадии происходит окончательное формирование смешанного твердого раствора состава NixZn1–xFe2O4. Авторы указывают на аналогичный механизм образования никель-цинкового и марганец-цинкового ферритов.
Изучение механизма образования никелевого, цинкового и никель-цинкового ферритов проводилось в [23]. Установлен состав реакционной зоны твердофазного взаимодействия NiO и (Ni, Zn)O с Fe2O3: это твердый раствор (Ni, Fe)O или (Ni, Zn, Fe)O и никель-цинковый феррит (Ni,Zn)Fe2O4. Указанные выше твердые растворы образуются в результате диффузии железа из ферритового слоя и оксида железа.
Для ферритов цинка, кадмия и никеля (II) определены энергии активации процесса ферритизации, равные соответственно 293 ± 20, 281 ± 20 и 327 ± 20 кДж/моль [76]. Исследован процесс образования цинкового феррита из смеси (ZnO)1–t:Fe2O3(1 + t) при 0 ? t ? 1. Установлено, что доля образовавшегося феррита (x) связана с t соотношением: x = 3(1 – t)(3 + t).
В [79, 80] химическая диффузия рассматривается с точки зрения электрохимического взаимодействия ионов. В [80] приведены уравнения феноменологической теории переноса в твердых телах. В ходе синтеза брикеты исходных веществ помещали между платиновыми электродами и проводили высокотемпературный обжиг при градиентах электрических полей от 1 до 1000 В/см. Отмечено, что скорость образования продукта возрастает с увеличением напряженности поля.
Рассмотренные выше закономерности позволяют сделать заключение, что для улучшения качества получаемых шпинелей и увеличения скорости их синтеза следует усиливать факторы, благоприятствующие протеканию диффузии: использовать более тонкие порошки, максимально тщательно их смешивать, повышать температуру спекания.