
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
2.2. Кинетика образования ферритов-хромитов кобальта (II)
Изучению кинетики синтеза твердых растворов состава CoFe2–xCrxO4 в литературе уделено недостаточное внимание. Между тем, шпинели такого состава являются ценным материалом с большим положительным значением константы магнитной кристаллографичнской анизотропии. Поэтому изучение кинетики образования твердых растворов состава CoFe2–xCrxO4 является актуальной задачей.
На концентрационной зависимости параметра решетки в ряду твердых растворов CoFe2–xCrxO4, так же, как и ZnFe2–xCrxO4, не установлено наличие критических элементов (рис. 2.8). Поэтому можно было ожидать корреляции изменения кинетических величин для шпинелей
CoFe2–xCrxO4 и ZnFe2–xCrxO4.
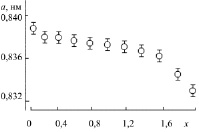
Рис. 2.8. Концентрационная зависимость параметра элементарной ячейки а твердых растворов CoFe2–хCrхO4
Образцы готовили аналогично описанному выше (см. п. 2.1). Синтез образцов осуществляли при температурах 900, 1000 и 1100 °С. Для идентификации фаз использовали картотеку ASTM, параметры элементарных ячеек определяли по линии (440). На рис. 2.9 приведены рентгенограммы образцов с параметром состава х = 0; 1,0; 2,0. Анализ рентгенограмм показывает, что синтезированные материалы имеют структуру кубической шпинели при всех значениях параметра состава х. Замещение ионов железа (III) ионами хрома (III) приводит к увеличению межплоскостных расстояний. Так, в феррите кобальта (II) самой интенсивной спектральной линией является d = 0,2500 нм, в хромите кобальта (II) – d = 0,2510 нм.
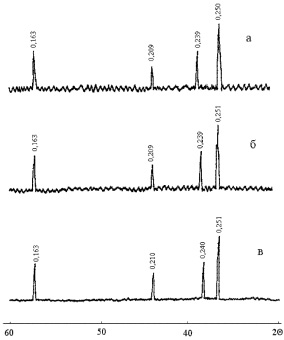
Рис. 2.9. Рентгенограммы образцов твердых растворов CoFe2–xCrxO4: а – х = 0,0; б – х = 1,0; в – х = 2,0
При расчете коэффициента диффузии D использовали формулу (1.2). Результаты расчета приведены в табл. 2.3 и представлены на рис. 2.10–2.12. При расчете величины v использовали отношение плотности оксида двухвалентного металла (?CoO = 6,7 г/см3 [168]) к величине рентгеновской плотности ?рент шпинельного твердого раствора по [45].
На рис. 2.10 приведена концентрационная зависимость коэффициента диффузии твердого раствора CoFe2–xCrxO4 при температуре 900 °С. Для сравнения на этом же рисунке изображена аналогичная зависимость для ZnFe2–xCrxO4. Следует отметить, что ход кривых имеет явную корреляцию. Однако в системе ZnFe2–xCrxO4 значения коэффициента диффузии D больше в 3,5–4 раза, что может быть связано с различной подвижностью диффундирующих частиц. Расчет величин энергии активации диффузии Q и предэкспоненциального множителя D0 проводили по методике, описанной выше (см. п. 2.1).
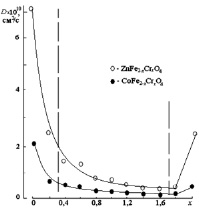
Рис. 2.10. Концентрационная зависимость коэффициента диффузии в твердых растворах MFe2–xCrxO4 (M – Co, Zn) при 900 °С
Таблица 2.3
Данные для расчета коэффициента диффузии в твердом растворе CoFe2–xCrxO4
|
Значения x |
Относительное увеличение объема продукта v |
T = 1173 K |
T = 1273 K |
Q, |
D0•105, см2/с |
||||
|
?•10–3, с |
D•1010, см2/с |
lgD |
?•10–3, с |
D•1010, см2/с |
lgD |
||||
|
0,0 |
2,244 |
108 |
2,063 |
–9,69 |
72 |
3,095 |
–9,51 |
111,43 |
2,148 |
|
0,2 |
2,247 |
360 |
0,618 |
–10,21 |
180 |
1,236 |
–9,91 |
115,86 |
0,791 |
|
0,4 |
2,256 |
612 |
0,362 |
–10,44 |
252 |
0,879 |
–10,06 |
117,71 |
0,617 |
|
0,6 |
2,264 |
612 |
0,361 |
–10,44 |
252 |
0,876 |
–10,06 |
117,71 |
0,615 |
|
0,8 |
2,273 |
972 |
0,226 |
–10,65 |
360 |
0,611 |
–10,21 |
120,85 |
0,484 |
|
1,0 |
2,284 |
972 |
0,225 |
–10,65 |
396 |
0,553 |
–10,26 |
120,85 |
0,482 |
|
1,2 |
2,292 |
1188 |
0,184 |
–10,74 |
468 |
0,466 |
–10,33 |
130,26 |
1,095 |
|
1,4 |
2,297 |
1296 |
0,168 |
–10,77 |
504 |
0,432 |
–10,36 |
130,26 |
0,910 |
|
1,6 |
2,302 |
1440 |
0,151 |
–10,82 |
648 |
0,335 |
–10,47 |
128,69 |
0,791 |
|
1,8 |
2,299 |
1332 |
0,163 |
–10,79 |
576 |
0,378 |
–10,42 |
123,99 |
0,525 |
|
2,0 |
2,302 |
360 |
0,603 |
–10,22 |
144 |
1,508 |
–9,82 |
109,86 |
0,456 |
Аналогично наблюдаемому для системы ZnFe2–xCrxO4, в случае твердых растворов CoFe2–xCrxO4 в интервале концентраций 0,4 ? х ? 1,6 наблюдается практически монотонное уменьшение коэффициента диффузии с уменьшением концентрации ионов Fe3+ в составе твердого раствора; в интервалах концентраций 0 ? х < 0,4 и 1,6 < х ? 2,0 значения D увеличиваются в 4–5 раз. Это подтверждает предложенный механизм формирования структуры ферритов-хромитов двухвалентных элементов – в составах, близких к «чистым» ферриту и хромиту твердый раствор оксида железа в оксиде хрома не образуется.
Концентрационная зависимость энергии активации диффузии (рис. 2.11) имеет излом в окрестности х = 1,2. Это может быть связано с изменением сорта диффундирующих частиц. В интервале концентраций 0 ? х ? 1,2 диффузия осуществляется, по-видимому, за счет ионов Fe3+ по типу (б) (рис. 1.2). С увеличением параметра х содержание катионов Fe3+ в составе твердого раствора уменьшается, концентрация Co2+ увеличивается (см. табл. 2.1), и при 1,2 < х < 2,0 происходит смена диффундирующих частиц – процесс осуществляется по типу (в) (рис. 1.2) за счет противодиффузии катионов кобальта и железа.
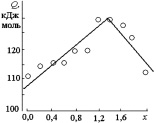
Рис. 2.11. Концентрационная зависимость энергии активации диффузии в твердом растворе CoFe2–xCrxO4
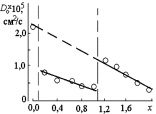
Рис. 2.12. Концентрационная зависимость предэкспоненциального множителя в твердом растворе CoFe2–xCrxO4
Для хромита кобальта (II), по-видимому, единственным видом диффундирующих частиц являются катионы Co2+, согласно отмеченному в [85]. Приведенным рассуждениям не противоречит изменение концентрационной зависимости предэкспоненциального множителя для твердых растворов CoFe2–xCrxO4 (рис. 2.11). В соответствии с полученными данными, коэффициент диффузии при Т > ? непрерывно уменьшается с уменьшением содержания катионов Fe3+ в составе твердого раствора. В интервале 0,2 ? х ? 1,2 значения D0 уменьшаются приблизительно в 2 раза, что может быть связано с кинетическими затруднениями, вызванными присутствием катионов хрома (III) в шпинели; однако общий вид зависимости сохраняется. При х > 1,2 количество катионов Со2+ в составе твердого раствора становится достаточным для смены механизма диффузии, и значение D0 вновь увеличивается.
Для реакций образования шпинелей состава CoFe2–xCrxO4 рассчитано значение температурного коэффициента скорости реакции по формуле (2.4). Для всех составов ? = 1,084 – 1,099, то есть, повышение температуры процесса на 10 градусов приводит к увеличению скорости реакции примерно на 9 %.
Таким образом, в ходе изучения кинетики формирования твердых растворов состава CoFe2–xCrxO4 выявлено, аналогично ZnFe2–xCrxO4, снижение значений величины коэффициента диффузии для составов с параметром 0,4 ? х ? 1,6; для шпинелей, близких к «чистым» ферриту и хромиту кобальта (II), отмечено увеличение коэффициента диффузии, что может быть связано с упрощением пути протекания процесса. На концентрационной зависимости энергии активации процесса диффузии выделены две области, связанные с различным механизмом формирования структуры.