
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
3.3. Формирование структуры шпинели по типу разложения солей
Как известно, оксид железа (II) при контакте с воздухом окисляется, поэтому синтез составов, содержащих катион Fe2 +, связан с определенными трудностями. Эти затруднения могут быть сняты, если в состав исходной шихты вводить легко разлагающееся (при температуре ниже температуры синтеза) соединение железа в соответствующем валентном состоянии. С помощью такого метода был осуществлен синтез хромитов никеля-меди-железа в системе CuxNiyFe1–x–yCr2O4 [98]. Для приготовления твердых растворов были составлены сырьевые смеси из оксидов никеля (II), меди (II), хрома (III). Катион Fe2+ вводили при помощи оксалата железа (II) 2-водного FeС2О4•2Н2О [98, 182]. В ходе термообработки это соединение разлагается по схеме [183]
FeС2О4•2Н2О = FeO + CO2 + CO + 2H2O (3.1)
или
FeC2O4•2H2O = Fe + 2CO2 + 2H2O (3.2)
На рентгенограммах образцов не обнаружены линии, характеризующие металлическое железо 9 реакция (3.2)), поэтому разложение оксалата железа (II) наиболее вероятно протекает в соответствии с уравнением (3.1). Далее формирование структуры проходит, по-видимому, как и для других составов хромитов.
С целью изучения фазообразования в системе CuO–NiO–Cr2O3–Fe2O3 при разложении солей, были получены ферриты-хромиты никеля-меди тремя способами [184].
1. Синтез проводили из растворов сульфатов соответствующих металлов. Раствор, содержащий смесь солей, упаривали до 1/3 объема в сушильном шкафу при температуре 100 °С. Затем полученный вязкий раствор насыщенного изумрудного цвета переносили в алундовый тигель, высушивали при температуре 120 °С до твердого состояния, подвергали термообработке при температуре 500 °С в течение 1 часа. Полученный прекурсор светло-коричневого цвета размалывали до размера зерен не более 0,38 мм, помещали в печь и подвергали ступенчатой термообработке при температурах 500–600–700–800–900 °С (скорость набора температуры составляла 12 °С/мин) с выдержкой при каждой температуре в течение 0,5–1,5 часов. При этом в интервале 700–800 °С наблюдали интенсивное выделение оксида серы (VI).
Фазовый состав изучали на рентгеновском дифрактометре STOE IPDS II, использовали Cu-K? излучение. Уточнение структуры фаз, входящих в образцы, проводили по рефлексам 220, 311, 222, 422, 333, 440, 533 для фазы кубической шпинели, 312 и 321 для фазы тетрагональной шпинели, 006 и 012 для хромита меди (I) в ромбоэдрической симметрии (параметры ячейки рассчитывали в гексагональной установке). Фотографии образцов были получены на сканирующем электронном микроскопе.
На рентгенограмме образца 1 (рис. 3.6, а) выявлены линии, соответствующие твердому раствору, кристаллизующемуся в структуре кубической шпинели; фазе состава CuCrO2 (Cu2Cr2O4), кристаллизующейся в ромбоэдрической симметрии; фазе оксида меди(II).
Фазообразование в системе, по-видимому, может быть описано следующими реакциями:
CuSO4 = CuO + SO3 (3.4)
NiSO4 = NiO + SO3 (3.5)
Fe2(SO4)3 = Fe2O3 + 3 SO3 (3.6)
Cr2(SO4)3 = Cr2O3 + 3 SO3 (3.7)
0,3 NiO + 0,3 Fe2O3 = 0,3 NiFe2O4 (3.8)
0,18 CuO + 0,18 Cr2O3 = 0,18 CuCr2O4
0,18 CuO + 0,18 CuCr2O4 = 0,18 Cu2Cr2O4 + 0,09 O2 (3.9)
0,31 CuO + 0,52 Cr2O3 = 0,52Cu0,6?0,4CrVI0,27CrIII1,73O4
0,3 NiFe2O4 + 0,52Cu0,6?0,4CrVI0,27CrIII1,73O4 =
= 0,82 Ni0,37Cu0,38?0,25Fe0,73CrVI0,17CrIII1,10O4.
Анализ профилей линий, характеризующих фазу кубической шпинели (рис. 3.6, а) показывает, что образующийся твердый раствор соответствует ферриту никеля (II), легированному катионами меди и хрома. Следует предположить, что в первую очередь образуется NiFe2O4 в соответствии с уравнением (3.8) за счет диффузии катионов Fe3+. Далее следует образование хромита меди (II) за счет диффузии катионов меди. По достижении температуры термообработки 900 °С начинает протекать реакция, описываемая уравнением (3.9) аналогично наблюдаемому в [185]. Оставшаяся часть оксидов хрома (III) и меди (II) взаимодействуют с образованием промежуточного соединения – дефектного хромита меди. В состав этого соединения, по-видимому, входят катионы хрома в шестивалентном состоянии. На заключительной стадии синтеза протекает процесс образования твердого раствора. Наличие CuO может быть связано с недостаточной продолжительностью термообработки.
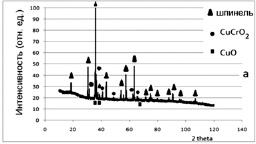
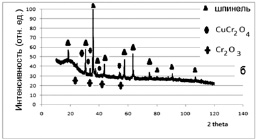
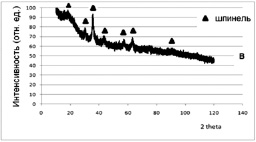
Рис. 3.6. Рентгенограммы образцов ферритов-хромитов никеля(II)-меди(II), полученных:
а – разложением сульфатов;
б – разложением сульфатов в лимонной кислоте;
в – разложением нитратов в полиакриламиде
Рассчитанные параметры решетки для синтезированных соединений приведены в табл. 3.8. Полученный материал имеет зерна округлой формы с размерами от 140 нм до 1,65 мкм (рис. 3.7).

Рис. 3.7. Микрофотография образца, полученного разложением сульфатов
Таблица 3.8
Параметры решетки и фазовый состав синтезированных материалов
|
Образец |
Параметры решетки, A |
||||
|
кубическая |
тетрагональная |
ромбическая |
|||
|
aк |
aт |
cт |
aр |
cр |
|
|
Образец 1 |
8,3214 |
– |
– |
2,9828 |
17,0928 |
|
Образец 2 |
8,3154 |
5,9865 (8,4662) |
7,9398 |
– |
– |
|
Образец 3 |
8,3219 |
– |
– |
– |
– |
2. Синтез проводили из растворов сульфатов соответствующих металлов. Раствор, содержащий смесь солей, помещали в реакционный сосуд, содержащий раствор лимонной кислоты. Наблюдали образование раствора насыщенного темно-зеленого цвета. Полученную смесь упаривали на песчаной бане при температуре 80 °С. Затем темный, очень вязкий раствор переносили в алундовый тигель, высушивали при температуре 120 °С. При этом прекурсор подвергался, вероятно, частичному разложению (наблюдали образование газа). Далее образец подвергали термообработке при температуре 500 °С в течение 1 часа. Полученный материал темно-зеленого цвета размалывали до размера зерен не более 0,38 мм, помещали в печь и подвергали ступенчатой термообработке при температурах 500–600–700–800 °С. В итоге образец имел вид мелкокристаллического порошка черного цвета. Образующийся твердый раствор (образец 2 (рис. 3.6, б)) состоит из кластеров, соответствующих твердому раствору, кристаллизующемуся в структуре кубической шпинели; тетрагональной шпинели на основе CuCr2O4; оксиду хрома(III).
Фазообразование в системе протекает в соответствии с реакциями (3.4)–(3.8) и
0,7 CuO + 0,65 Cr2O3 = 0,41 CuCr2O4 + 0,29 CuCrIII1,32CrVI0,34?0,34O4
0,3 NiFe2O4 + 0,41CuCr2O4 = 0,71 Ni0,42Cu0,58Fe0,85Cr1,15O4.
Анализ линий, характеризующих фазу тетрагональной шпинели на основе хромита меди, свидетельствует о высокой дефектности образующегося соединения (рис. 3.6, б).
Рассчитанные параметры решетки для синтезированных соединений приведены в табл. 3.9. Полученный материал имеет мелкие зерна, по форме близкие к октаэдру, с размерами от 95 до 0,45 мкм (рис. 3.8).

Рис. 3.8. Микрофотография образца, полученного разложением солей в лимонной кислоте
3. Синтез проводили из растворов нитратов соответствующих металлов с концентрацией 0,5–1,5 моль/л. Полученный раствор помещали в водный раствор аммиака, поддерживая значения рН в интервале 7,5–8, затем смешивали с водным раствором полиакриламида, выпаривали на песчаной бане и подвергали термообработке до полного разложения органической составляющей. При этом наблюдали бурное протекание процесса, сопровождающееся свечением и выделением газов. Образец имел вид мелкокристаллического порошка черного цвета. На рентгенограмме образца 3 (рис. 3.6, в) выявлены линии, соответствующие твердому раствору, кристаллизующемуся в структуре шпинели.
В ходе термообработки смеси исходных веществ протекает процесс разложения прекурсоров с образованием соответствующих оксидов. Далее фазообразование в системе может быть представлено, по-видимому, реакциями
0,3 NiO + 0,3 Fe2O3 = 0,3 NiFe2O4,
0,7 CuO + 0,7 Cr2O3 = 0,7 CuCr2O4,
0,3 NiFe2O4 + 0,7CuCr2O4 = Ni0,3Cu0,7Fe0,6Cr1,4O4.
Рассчитанные параметры решетки шпинели приведены в табл. 3.8. Полученный материал имеет вид плава с включениями мелких кристаллов с размерами приблизительно от 80 до 170 нм (рис. 3.9).

Рис. 3.9. Микрофотография образца, полученного разложением солей в полиакриламиде
В общем случае следует отметить, что ходе реакции разложения солей протекает реакция шпинелеобразования. В присутствии лимонной кислоты и полиакриламида процесс протекает полнее и при более низкой температуре термообработки, при этом фаза делафоссита не образуется. В процессе синтеза материалов при разложении солей с использованием органического связующего удается получить вещества с меньшим размером зерен. Это должно положительно сказаться на процессах, протекающих по поверхности материала – в частности, каталитических и адсорбционных.
Таким образом, в ходе изучения методов активированного спекания шпинелей установлено следующее:
1. Введение в состав шихты 0,5–1 % (масс.) хлорида калия на стадии гомогенизации позволяет проводить процесс формирования структуры шпинели в 10–100 раз быстрее и, как правило, с одновременным понижением температуры термообработки.
2. Установлено ускоряющее действие добавки хлорида калия в реакциях шпинелеобразования для всех образцов состава MFe2–xCrxO4 (M = Co, Ni, Cu, Zn).
3. Выявлено, что введение в состав шихты хлорида калия понижает энергию активации процесса на 30–50 %.
4. Выявлено, что добавки хлорида калия не входят в состав конечного продукта.
5. Изучен процесс фазообразования в ходе реакции разложения солей – сульфатов и нитратов никеля (II), меди (II), хрома (III), железа (III). Установлено, что в ходе реакции протекает процесс образования шпинелей, при этом полнота протекания процесса выше в случае присутствия в качестве прекурсора органической составляющей. В процессе разложения сульфатов металлов при температуре термообработки 900 °С в образцах отмечено присутствие фазы CuCrO2.