
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Лабораторная работа № 2. ИССЛЕДОВАНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ АЛМАЗНОГО ЭЛЕКТРОДА В ВОЛЬФРАМАТНЫХ РАСПЛАВАХ
Теоретические основы потенциометрии
Равновесные методы электрохимического анализа основаны на измерении э.д.с. электрохимических цепей, для которых потенциал электрода близок к равновесному значению. При этом суммарный ток, протекающий между электрохимической системой и внешней измерительной цепью равен нулю или к такому значению, которое не приводит к заметному отклонению потенциала от его величины при нулевом токе. Проведение измерений не оказывает заметного влияния на равновесия, существующие на границе раздела фаз и в глубине раствора.
Потенциометрия объединяет методы определения различных физико-химических величин и концентраций веществ, основанные на измерении электродвижущих сил (э.д.с.) обратимых электрохимических цепей, когда рабочий электрод имеет потенциал, близкий к равновесному значению.
Потенциометрия представляет собой метод определения концентраций веществ, а также различных физико-химических величин, основанный на измерении потенциалов электродов. Измерение электродных потенциалов и нахождение зависимости между ними и концентрацией (активностью) определяемых компонентов позволяет установить не только концентрацию (активность) ионов, но и ряд других характеристик: константы диссоциации слабых электролитов и константы устойчивости комплексных соединений, произведения растворимости малорастворимых осадков, стандартные и формальные электродные потенциалы, окислительно-восстановительные потенциалы, число электронов, участвующих в потенциалопределяющей стадии и т.д.
Потенциометрию применяют как для непосредственного определения концентрации (активности) вещества, находящегося в растворе
(прямая
потенциометрия), так и для определения точки эквивалентности титрования
(потенциометрическое титрование), измеряя потенциал индикаторного
электрода в зависимости от количества добавленного титранта.
Основы потенциометрии заложены В. Нернстом, который в 1889 г. получил известное уравнение для равновесных электродных потенциалов. Вскоре потенциометрия начала применяться в аналитической химии и в 1893 г. Р. Беренд провел первое потенциометрическое титрование. В настоящее время потенциометрия широко применяется в аналитической и физической химии.
Потенциометрическое титрование
Потенциометрическое титрование основано на определении эквивалентной точки по изменению потенциала на электродах, опущенных в титруемый раствор. При потенциометрическом титровании используют электроды как неполяризующиеся (без протекания через них тока), так и поляризующиеся (с протеканием через них тока).
В процессе титрования определяется концентрация в растворе одного из ионов, для регистрации которого имеется подходящий электрод.
Потенциал Ех на этом индикаторном электроде устанавливается согласно уравнению Нернста. Например, для реакций окисления- восстановления уравнение Нернста выглядит следующим образом:
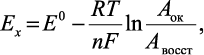
где Ех – потенциал электрода в данных конкретных условиях; Аок – концентрация окисленной формы металла; Авосст – концентрация восстановленной формы металла; Е0 – нормальный потенциал; R – универсальная газовая постоянная (8316 дж(град-моль); Т – р абсолютная температура; n – разность валентностей окисленной и восстановленной форм ионов металла.
Для образования электрической цепи в титруемый раствор помещают второй, так называемый электрод сравнения, например каломельный, потенциал которого в процессе реакции остается постоянным. Потенциометрическое титрование на неполяризующихся электродах помимо упомянутых реакций окисления – восстановления используется также при реакциях нейтрализации. В качестве индикаторных электродов при реакциях окисления – восстановления применяют металлы (Pt, Wo, Mo). При реакциях нейтрализации применяют чаще всего стеклянный электрод, имеющий в широкой области характеристику, аналогичную водородному электроду. Для водородного электрода зависимость потенциала от концентрации ионов водорода выражается следующей зависимостью:
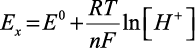
или при 25 °С E = E0 – 0,058 pH.
При потенциометрическом титровании часто используют титрование не до определенного потенциала, а до определенной величины рН, например, до нейтральной среды рН = 7. Несколько в стороне от общепринятых методов потенциометрического титрования (без протекания тока через электроды) стоят методы потециометрического титрования при постоянном токе с поляризующимися электродами. Чаще применяют два поляризующихся электрода, но иногда пользуются и одним поляризующимся электродом.
В отличие от потенциометрического титрования с неполяризующимися электродами, при котором ток через электроды практически не протекает, в данном случае через электроды (обычно платиновые) пропускается небольшой (около нескольких микроампер) постоянный ток, получаемый от источника стабилизированного тока. В качестве источника тока может служить высоковольтный источник питания с последовательно включенным относительно большим сопротивлением. Измеряемая на электродах разность потенциалов резко возрастает при приближении реакции к эквивалентной точке вследствие поляризации электродов. Величина скачка потенциала может быть гораздо больше, чем при титровании при нулевом токе с неполяризующимися электродами.
К достоинствам потенциометрического титровании относятся высокая точность и воспроизводимость анализов, возможность определять содержание компонентов в мутных и сильно окрашенных растворах, анализировать смеси, близкие по свойствам, кислот и оснований, окислителей и восстановителей без разделения. К недостаткам метода можно отнести мешающее влияние посторонних ионов на электродный потенциал, возможность «отравления» металлических электродов, инерционность электродов и некоторые другие.
Кривые потенциометрического титрования определяются приведенным выше уравнением Нернста и принадлежат к S-образному виду.
Определение конечной точки для данного вида кривой производится:
а) по скачку потенциала, когда потенциал на электродах становится больше заданного, соответствующего конечной точке титрования;
б) по скачку потенциала первой производной от основной кривой титрования; увеличивающийся в конечной точке Потенциал сравнивается с заданным;
в) по двойному скачку потенциала второй производной от основной кривой титрования; в конечной точке титрования кривая величины потенциала проходит через нуль, что фиксируется нуль-индикатором схемы.
При титрованиях с поляризующимися электродами кривая титрования близка по форме к кривой первой производной от S-образной кривой титрования; аналогичны и схемы индикации конечной точки этих видов титрований.
Величина скачка потенциала и наклон кривой в области эквивалентной точки зависят от природы и концентрации взаимодействующих веществ. При уменьшении концентрации реагирующих веществ уменьшается и скачок потенциала, что увеличивает вероятность получения большей ошибки при индикации конечной точки титрования.
Методика потенциометрического анализа в ионных расплавах
Ионные расплавы находят широкое применение в качестве сред для проведения различных электрохимических процессов. Полная ионизация растворителя и его практическая индифферентность выгодно отличают солевые расплавы от других растворителей, позволяя создавать высокие плотности тока на электродах и получать продукты, неустойчивые в других условиях.
На течение химических процессов в расплавах значительное влияние оказывают примеси, содержащиеся в расплаве – растворителе. Взаимодействуя с реагентами, они могут вызвать значительное уменьшение их равновесной концентрации, часто сопровождаемое образованием других продуктов или новых фаз. Количественное изучение реакций изучение реакций с участием примесей имеет важное значение для оценки их влияния на свойства расплава, а также сведения этого влияния к минимуму путем удаления примесей из расплава или связывания их в малодиссоциированные комплексы.
Реакции с переносом оксид – иона, не сопровождающиеся изменением степени окисления реагирующих веществ, определяются по Люксу–Флуду как кислотно-основные. Донор оксид – иона является основанием, а акцептор – кислотой.
Наиболее часто изучение кислотно-основных равновесий в расплавах проводится потенциометрическим методом с применением различных индикаторных кислородных электродов. Потенциометрия объединяет методы определения различных физико-химических величин и концентраций веществ, основанные на измерении электродвижущей силы правильно разомкнутой цепи, состоящей из обратимого электрода сравнения и исследуемого рабочего электрода, потенциал которого близок к равновесному значению.
Метод потенциометрии используется для изучения кислотно – основных равновесий в расплавленных средах. Этот метод впервые использован Люксом в его классических работах.
В соответствии с представлениями Люкса, кислотно-основные свойства кислородсодержащих расплавов рассматриваются как донорно-акцепторные взаимодействия по отношению к иону О2–. Мерой кислотности (основности) данных расплавов служит величина:
pО 2– = – lg[О 2– ].
Расплав тем основнее, чем легче он отдает кислородный ион частице, участвующей в кислотно-основном равновесии, или равновесному кислородному электроду.
Экспериментальное исследование химического поведения алмаза в оксидных расплавах показывают, что на поверхности алмаза при контакте с расплавом протекают окислительно-восстановительные процессы. Последнее способствует возникновению электрохимического потенциала и равновесия на границе поверхность алмаза – расплав.
Проведения измерения потенциала алмазного и платинового электродов в расплаве KCl–NaCl–Na2WO4 и смесях на его основе (WO3, Na2CO3) при температуре 750 °С относительно платино-кислородного электрода сравнения.
Потенциал алмазного и платинового электродов реагирует на изменение кислотно-основных свойств расплава. Природа потенциалопределяющих процессов на этих электрода:
С(алмаз) + O 2– – 2e– = CO
Pt + O 2– – 2e– = PtO
Для потенциалов этих электродов можно записать:
Еалмаз = Е 0,алмаз – (RT/2F) ln[CO]/[O 2– ]
Е платина = Е 0,платина – (RT/2F) ln[PtO]/[O 2– ]
Еалмаз = Е 0,алмаз + (2,3 RT/2F) pO 2
Еплатина = Еплатина + (2,3 RT/2F) pO 2
Измерение ЭДС гальванической цепи Pt, C(алмаз) /KCl–NaCl/KCl–NaCl–xNa2WO4/Na2WO4 – 0,2 моль. % WO3/Pt, (O2)
Последовательность проведения измерений
1. Приготовить 30 г эквимольной смеси KCl–NaCl в алундововм тигле и расплавить при температуре 750 °С.
2. Измерить потенциал алмазного электрода в хлоридном расплаве KCl–NaCl (эквимольная смесь) [потенциал должен оказаться в пределах 0,3–0,6 В]
3. Измерить потенциал алмазного электрода в хлоридном расплаве KCl–NaCl (эквимольная смесь) – Na2WO4 с последовательным увеличением концентрации:
1) 0,5 моль. %;
2) 1,0 моль. %;
3) 2,5 моль. %;
4) 5,0 моль. %; [потенциал должен возрастать]
4. Построить зависимость – E – f(c(Na2WO4)) для алмазного электрода.
5. Оформить отчет в виде таблицы
|
№ п/п |
c (Na2WO4), моль. % |
φалмаз, В |
Δφ, В |
|
1 |
0,5 |
|
|
|
2 |
1,0 |
|
|
|
3 |
2,5 |
|
|
|
4 |
5,0 |
|
|
