
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Лабораторная работа № 3. ИССЛЕДОВАНИЕ ЭЛЕКТРОВОССТАНОВЛЕНИЯ ФТОРОКСИДНЫХ КОМПЛЕКСОВ ВОЛЬФРАМА НА ФОНЕ РАСПЛАВА KCl‒NaCl‒CsCl НА ПЛАТИНОВОМ КАТОДЕ МЕТОДОМ ЦИКЛИЧЕСКОЙ ВОЛЬТАМПЕРОМЕТРИИ
Теоретические основы вольтамперометрии
Под вольтамперометрией понимается большая группа методов изучения кинетики электродных процессов, в которых во времени изменяется потенциал исследуемого электрода (обычно по линейному закону) и измеряется ток, протекающий через электрохимическую ячейку; т.е. эта группа методов, основанных на получении и расшифровке вольтамперных зависимостей межфазной границы поляризующийся электрод – раствор электролита.
В вольтамперометрии с линейной разверткой напряжение изменяется
между двумя предельными значениями с постоянной скоростью. Это изменение
может быть однократным или циклическим в виде треугольных волн, причем
проводятся измерения соответствующего тока. Этот метод часто
используется для получения количественных или полуколичественных
представлений об электродной системе. По вольтамперометрическим кривым
можно приблизительно проверить обратимость электродной системы,
выяснить, имеет ли место многостадийность, распознать фарадеевский
и нефарадеевский адсорбционно-десорбционный процессы и с помощью
циклической вольтамперометрии определить электроактивные промежуточные
соединения. Вольтамперометрия с линейной разверткой является особенно
мощным средством для исследования сложных электродных процессов, если
она применяется совместно с другими методами, такими, как оптическая
абсорбционная спектроскопия и электронно-спиновая резонансная
спектроскопия.
Методы, при которых потенциал меняется во времени достаточно медленно (1...4 мВ/с), так, что наблюдаемые явления могут быть описаны количественно на основании равновесных или квазиравновесных теорий, называется классической или стационарной вольтамперометрией (КВА). При малых скоростях поляризации электродной системы запись вольтамперных кривых осуществляется обычно с помощью электронных потенциометров. Другой разновидностью вольтамперометрического метода является вольтамперометрия с быстрой разверткой потенциала. В этом случае скорость поляризации рабочего электрода составляет от 10 мВ/с до 100 В/c. Классическая кривая имеет предельный ток (I пр), а в вольтамперометрии с линейной разверткой потенциала – четко выраженный максимум (пик). В качестве основных, экспериментально определяемых параметров в методе классической вольтамперометрии служат предельный ток Iпр и потенциал полуволны φ 1/2 (при I = I пр/2), а в методе вольтамперометрии с линейной разверткой потенциала – ток пика Ip и потенциал полупика φ 1/2 (при I p/2).
Теория классической и вольтамперометрии при линейной развертке потенциала применительно к простым и сложным электрохимическим процессам рассмотрена в монографиях Д. Плэмбэка и З. Галюса. Методы с быстрой разверткой потенциала, в которых направление изменения потенциала меняется на обратное, называются циклическими. Циклическая вольтамперометрия (ЦВА) представляет собой вольтамперометрический метод, в котором фиксируется изменение во времени тока, протекающего через изучаемую систему при наложении на нее напряжения, изменяющегося во времени по закону треугольника. Теоретические основы ЦВА разработаны Николсоном и Шейном, а также обзор теоретических положений дан Адамсоном. Независимыми переменными в этом методе являются скорость и пределы изменения потенциала индикаторного электрода. Предельное значение потенциала, при котором направление его развертки меняется на обратное, называется потенциалом возврата, переключения или обрыва. Рассмотренные выше вольтамперометрические методы являются одними из наиболее информативных. Но при изучении электрохимического поведения ионов вольфрама, молибдена и диоксида углерода нами будут использоваться классическая вольтамперометрия и вольтамперометрия с линейной разверткой потенциала. Рассмотрим основы теории этого метода.
Классическая вольтамперометрия
Рассмотрим случай обратимой электродной реакции,
Ох + ne ↔ Red, (1)
которая протекает на плоском электроде в условиях избытка индифферентного электролита в исследуемом расплаве. Лимитирующей стадией процесса является диффузия разряжающихся ионов Ox к поверхности индикаторного (рабочего) электрода. В этих условиях массоперенос осуществляется путем полубесконечной линейной диффузии и у поверхности электрода возникает изменяющийся во времени градиент концентрации ионов Ox. Решая дифференциальное уравнение Фика относительно концентраций Cox(x, t) и СRed(x, t) при x = 0 и подставляя их значения в уравнение Нернста, получаем зависимость, которая описывает классическую полярограмму. При этом различают случай, когда продукт реакции (2.1) растворим в расплаве или материале электрода, то есть имеет место сплавообразование (случай а), или продукт Red нерастворим и накапливается на поверхности индикаторного электрода (случай б):
а) восстановление и окисление растворимых веществ
Для этого случая связь между потенциалом и током в любой точке вольтамперной кривой описывается уравнением Гейровского–Ильковича:
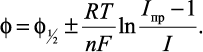 (2)
(2)
Знак плюс в уравнении (2) относится к процессу катодного восстановления, а минус ? к реакции анодного окисления вещества.
б) восстановление и окисление нерастворимых веществ
В этом случае вещество Red, образующееся в ходе реакции (1) нерастворимо ни в расплаве, ни в материале электрода, поэтому уравнение Гейровского-Ильковича можно упростить. Наличие вещества на поверхности электрода позволяет принять его активность аRed = 1 (γRed = 1; CRed = 1); при этом уравнение вольтамперной кривой принимает следующий вид:
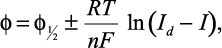 (3)
(3)
где как и ранее плюс относится к катодной реакции, а минус – к анодной. Уравнение (3) называют уравнением Кольтгоффа–Лингейна.
Для того, чтобы установить, каким уравнением – (2) или (3) – описываются экспериментальные вольтамперные кривые, необходимо провести их графический анализ, который заключается в построении зависимостей:
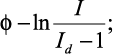
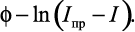
Полученная линейная зависимость позволяет таким образом установить вид уравнения, которым необходимо пользоваться в каждом конкретном случае при расчете опытных кривых. Тангенс угла наклона прямой позволяет определить число электронов n, участвующих в электродной реакции (1).
Вольтамперометрия при линейной развертке потенциала
Зависимости ток – потенциал в методе вольтамперометрии c линейной разверткой потенциала существенно зависят от типа электродной реакции.
Рассмотрим случай обратимого процесса (1), скорость которого ограничена массопереносом ионов в условиях линейной полубесконечной диффузии к плоскому электроду. Аналогично методу КВА, в данном методе также необходимо различать тот случай, когда продукт электродной реакции (1) Red растворим в расплаве или материале электрода, и случай, когда вещество Red нерастворимо:
а) восстановление или окисление растворимых веществ
В данной задаче для нахождения зависимости I-φ необходимо решить дифференциальное уравнение Фика при следующих граничных условиях:
t > 0, x = 0.
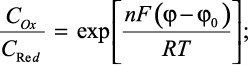 (4)
(4)
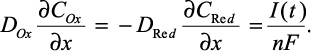 (5)
(5)
Условие (4) получено из уравнения Нернста, а уравнение (5) отражает тот факт, что массоперенос веществ Ox и Red у поверхности электродов одинаков. В вольтамперометрии с линейной разверткой потенциала потенциал является функцией времени:
φ = φi ± v t, (6)
где v - скорость поляризации электрода (В/с). Плюс относится к анодной поляризации, а минус - к катодной.
Впервые эта задача была решена независимо Рэндлсом и Шевчиком. В общей форме зависимость I?φ получена в следующем виде:
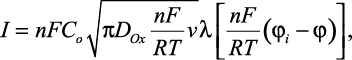 (7)
(7)
где l - функция, зависящая от потенциала. С учетом (7) ток в максимуме вольтамперной кривой (ток пика) равен:
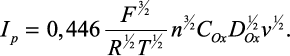 (8)
(8)
Потенциал пика φp определяется следующим соотношением:
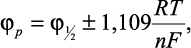 (9)
(9)
где плюс относится к анодному процессу, а минус - к катодному. Разность значений потенциалов пика φр и полупика φ р/2 составила:
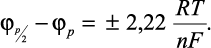 (10)
(10)
Уравнение (10) обычно используется для оценки числа электронов n, участвующих в электродной реакции (1).
б) восстановление или окисление нерастворимых веществ
В этом случае активность продукта электродной реакции (1) равна 1, что учитывается при формировании граничного условия (4), полученного на основе уравнения Нернста при t > 0, x = 0:
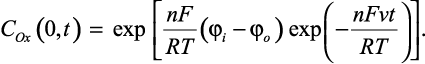 (11)
(11)
Решение этой задачи впервые выполнено Берзинсом и Делахеем, которые получили зависимость I-φ в виде:
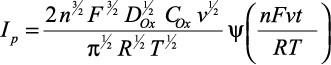 (12)
(12)
Уравнение для потенциала пика получено в виде:
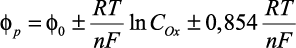 , (13)
, (13)
где плюс относится к анодному процессу, а минус – к катодному.
Для установления механизма электродных процессов весьма ценным является также использование развертки потенциала в обратном направлении. По разности потенциалов катодного и анодного пиков, подчиняющейся для обратимых процессов соотношению:
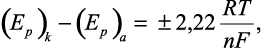 (14)
(14)
а также по соотношению высот анодного и катодного пиков тока можно охарактеризовать скорость процесса переноса заряда.
В вольтамперометрии наблюдаемая плотность тока является суммой нефарадеевского iнф и фарадеевского iф токов, что соответствует разделению этих компонентов тока в виде:
i = iнф + iф = CddE/dt + iф . (15)
При скоростях поляризации до 1 В/с плотность нефарадеевского тока обычно мала по сравнению с фарадеевским. При более высоких скоростях развертки потенциала нефарадеевский компонент может стать довольно большим и оказать значительное влияние на форму вольтамперных кривых.
Методы с быстрой разверткой потенциала
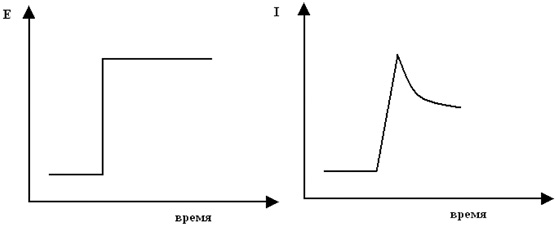
Если скорость изменения потенциала в вольтамперометрии становится выше нескольких милливольт в секунду, то из-за недостатка времени в приэлектродном пространстве не успевает устанавливаться устойчивое квазиравновесное распределение концентрации между электродом и объемом раствора. Названия этих методов довольно разнообразны, хотя все они представляют собой просто вольтамперометрию при высоких скоростях изменения напряжения. Вольтамперометрию с быстрой разверткой потенциала правильнее называть хроноамперометрией с линейной разверткой потенциала. Она известна также под устаревшими названиями: одноцикличной пиковой вольтамперометрии, вольтамперометрии с быстрой линейной разверткой и вольтамперометрии на стационарном электроде. Простейший хроноамперометрический налагаемый на электрод сигнал – ступенчатое изменение потенциала – показан на рис. 3.
а б
Рис. 3. Хроноамперометрия без линейной развертки:
а – форма
налагаемого на электрод сигнала, используемого при изучении процесса
восстановления, крутизна подъема – завышена; б – экспериментальная
кривая ток-время, полученная для одноступенчатого обратимого
восстановления
Вольтамперометрия с быстрой разверткой потенциала
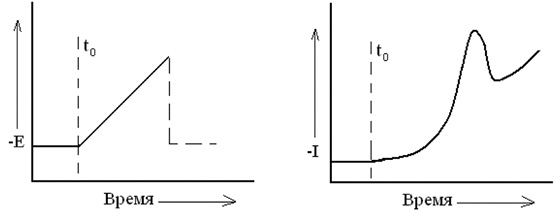
В вольтамперометрии с быстрой разверткой потенциала или хроноамперометрии с линейной разверткой используется изменение потенциала, показанное на рис. 4.
а б
Рис. 4. Хроноамперометрия с линейным изменением потенциала:
а –
поляризующий сигнал, подъем потенциала начинается при to, падение
потенциала после подъема не используется; б – кривая ток-время,
полученная для одноступенчатого обратимого процесса
Предположение, что электродный потенциал является равновесным и перестает быть справедливым, если скорость изменения напряжения делается достаточно высокой. Скорость развертки потенциала, при котором это становится заметным, зависит от условий проведения электролиза и от характера электрода. На ртутном капающем электроде при обычных условиях полярографирования влияние скорости развертки можно ожидать при скоростях выше 10 мВ/с. На электроде с неизменной площадью поверхности влияние скорости развертки может сказаться при меньших ее скоростях.
Обычная скорость изменения потенциала при хроноамперометрии с линейной разверткой составляет от 15 до 50 мВ/с (тогда как в классической полярографии она равна от 2 до 3 мВ/с).
Если на электрод подается потенциал, меняющийся ступенеобразно, как показано на рис. 1, снижение тока обусловлено уменьшением скорости подачи электрохимически активного вещества к поверхности электрода по мере расширения диффузионного слоя. В отсутствие электрохимически активного вещества наблюдается лишь экспоненциальное падение тока заряжения; применительно к методам со скоростной разверткой о нем пойдет речь в следующей главе. Если же поверхность электрода непостоянна, то следует принимать во внимание характер ее изменения во времени. Однако современные приборы, использующие быструю развертку потенциала, работают с отбором тока в течение очень короткого периода времени в конце жизни капли, так что площадь РКЭ при этом остается почти постоянной.
Быстрое изменение потенциала (характер которого приведен на рис. 2) вызывает появление пикообразной кривой тока, как это показано на том же рисунке. Измерение тока пика осуществляется от уровня повышающейся фоновой линии, обусловленной током заряжения; кривую этого тока необходимо фиксировать отдельно перед добавлением электрохимически активного вещества в индифферентный электролит. Качественно начальный участок подъема тока является экспоненциальным. Для процессов, определяемых скоростью переноса электрона, этот подъем должен подчиняться уравнению Тафеля. Когда сила тока превысит приблизительно 10 % максимальной силы тока пика, экспоненциальный подъем, замедляется из-за уменьшения скорости подачи электрохимически активного вещества к электроду вследствие расширения, диффузионного слоя. Далее ток становится диффузионно-ограничейным; на электроде с неизменной поверхностью этот ток уменьшается во времени, поэтому нельзя получить постоянное, не изменяющееся во времени значение тока.
Если два или более электрохимически активных вещества независимо восстанавливаются или окисляются из одного и того же раствора, то линией отсчета для последующего пика является продолжение ниспадающей части предыдущего пика. Эту ниспадающую часть можно определить экспериментально, если остановить развертку напряжения до потенциала появления последующего пика и проследить падение тока во времени при постоянном потенциале. Если остановка сделана при потенциале, достаточно далеко отстоящем от потенциалов предшествующего и последующего пиков (между ними), то ток является диффузионно-ограниченным, и его уменьшение во времени определяется только уменьшением диффузионно-ограниченного тока. Последующие пики, таким образом, можно отмерять от уровня этой падающей линии, как будто бы предшествующего пика вовсе не было. Если же потенциалы двух процессов разделены между собой менее чем на 100 мВ или если эти процессы протекают не независимо, то использование линии отсчета, получаемой таким способом, не является строго корректным.
Единственным преимуществом метода с быстрой разверткой потенциала как метода анализа является возможность количественного определения веществ при более низких концентрациях, чем это позволяет классическая полярография (вплоть до 1 мкмоль/дм3). В то же время рассмотренные методы имеют несколько существенных недостатков, не говоря уже о том, что они требуют использования специальной быстродействующей регистрирующей аппаратуры. К числу особенно важных недостатков относятся следующие. Во-первых, линия отсчета всегда является наклонной, особенно если используется РКЭ, на котором по мере роста капли происходит увеличение фарадеевского тока. Во-вторых, ни метод калибровочных кривых, построенных по известным стандартным растворам, ни метод стандартных добавок в данном случае использовать нельзя, а теоретические уравнения, связывающие высоту пика с концентрацией, практически малоудобны. В-третьих, поверхность электрода не обновляется, я на ней могут накапливаться продукты электродных реакций, если только не используется РКЭ, у которого линия отсчета имеет большую крутизну. Методы с быстрым изменением потенциала целесообразно использовать для изучения механизма и кинетики электродных процессов, а как аналитические приемы определения веществ в растворе они явно уступают импульсным полярографическим методам.
Циклическая вольтамперометрия
Методы с быстрой разверткой потенциала, у которых направление изменения потенциала меняется на обратное, называются циклическими. В этих методах подъем потенциала происходит во всем рабочем диапазоне их изменения, после чего направление развертки меняется на обратное, так что при обратном изменении потенциала он возвращается практически к исходному значению. Скорость изменения потенциала в прямом и обратном направлениях обычно одна и та же, так что форма поляризующего сигнала (напряжения) представляет собой равнобедренный треугольник. Таким образом, циклическая вольт-амперометрия представляет собой вольтамперометрический метод, в котором фиксируется изменение во времени тока, протекающего через изучаемую систему при наложении на нее напряжения, изменяющегося во времени по закону треугольника (рис. 5).
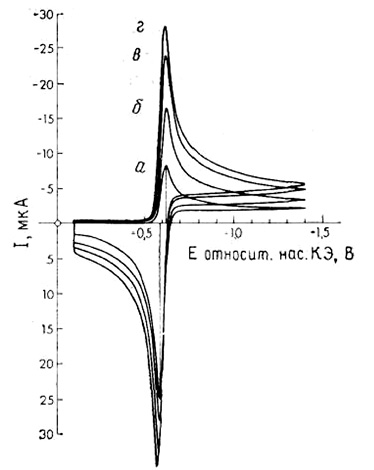
Рис. 5. Циклическая вольтамперограмма для обратимого процесса.
Водный
1,0 моль/м3 раствор Cd (II) в 100 моль/м3 КС1; электрод в виде висящей
ртутной капли. Скорости изменения потенциала (мВ/с):
20 (а), 50 (б), 100 (в) и 200 (г)
Обычно зависимость изменения потенциала во времени представляет
собой равнобедренный треугольник, хотя такая форма поляризующего сигнала
не является строго необходимой. Циклическая вольтамперометрия может
быть одноцикличной (рис. 6) или многоцикличной в зависимости от
электрода, изучаемого процесса и требуемой информации. В большинстве
случаев первый и последний циклы не идентичны. Для количественных
измерений многоцикличная вольтамперометрия не используется, так как
количественная теория этого метода до сих пор не разработана. Однако она
весьма полезна при исследовании сложных
процессов.
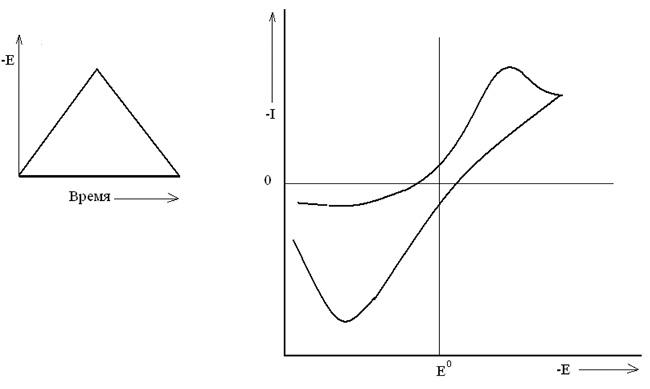
а б
Рис. 6. Циклическая вольтамперометрия:
а – поляризующий сигнал; б – кривая тока, полученная
для одноступенчатого восстановления
В циклической вольтамперометрии измеряют потенциалы катодного и анодного пиков Е п-к и Е п-а, а, токи катодного и анодного пиков Iп,а и Iп,к, потенциалы полупиков Еп/2 к и Еп/2 а, т.е. такие потенциалы на кривой, при которых катодный и анодный токи достигают половины пиковых значений. (рис. 7).
Независимыми переменными здесь служат скорость изменения потенциала и пределы изменения потенциала. Первая из этих переменных является более важной с точки зрения возможности распознавания механизма процесса, хотя правильный выбор пределов изменения потенциала часто позволяет избежать влияния других процессов.
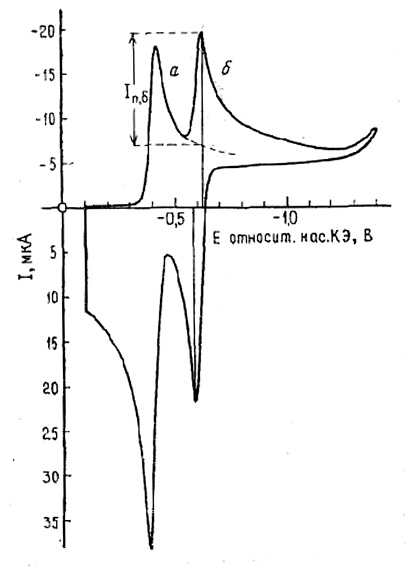
Рис. 7. Циклическая вольтамперометрия
для многоступенчатых обратимых процессов:
а – восстановление РЬ(II); б – восстановление Cd(II)
Водный 10,0 моль/м3 раствор Cd(II) и Pb(II) в 100 моль/м3 KCI; электрод в виде висящей ртутной капли. Начало, поляризации катодное, скорость развертки 50 мВ/с. Диапазон изменения потенциала от –0,20 до –1,55 В.
Последовательность выполнения эксперимента
1. Расплавить эвтектическую смесь состава KCl – 19,5 %;
NaCl – 12,5 %; CsCl – 68,0 % в стеклоуглеродном тигле при температуре 550 °С.
2. Включить потенциостат Autolab PGSTAT30.
3. Подключить индикаторный электрод, противоэлектрод и электрод сравнения к соответствующим разъемам на потенциостате.
4. Измерить потенциал индикаторного электрода относительно электрода сравнения.
5. Включить программу NOVA на ПК.
6. Провести съемку вольтамперной кривой фонового расплава при следующих параметрах: Енач = 0 В, Еконечн = –2,8 В, v = 0,1 В/c. Сохранить результаты съемки.
7. Добавить в фоновый расплав WO3·3NaF или (Na3WO3F3), концентрация, с = 3,0·10 –4 моль/см3. Сохранить результаты съемки.
8. Провести обработку экспериментальных результатов.
