
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.3. Изотопный состав воды
Молекулы воды отличаются друг от друга по своему изотопному составу. В настоящее время известны 5 различных изотопов водорода. Из них только два являются стабильными: самый легкий протий – с атомной массой 1, его обозначают символом 1Н – состоит из 1 протона и 1 электрона, и тяжелый водород, или дейтерий с атомной массой 2, его обозначают символом 2D – состоит из 1 протона, 1 нейтрона и 1 электрона. Третий сверхтяжелый водород (с атомной массой 3) соответственно состоит из 1 протона, 2-х нейтронов и 1 электрона. Тритий радиоактивен, его период полураспада около 12,3 лет. Время жизни остальных изотопов не превышает нескольких секунд [16–17].
У кислорода обнаружены шесть изотопов: О14, О15, О16, О17, О18 и О19. Три из них: О16, О17 и О18 – стабильные, а О14, О15 и О19 являются радиоактивными изотопами. Стабильные изотопы кислорода содержатся во всех природных водах: их соотношение таково: на 10000 частей О16 приходится 4 части О17 и 20 частей О18 [19–21].
Изотопные или изотопические эффекты воды основаны на различиях в свойствах изотопов водорода и кислорода, обусловленных разницей их атомных масс, моментов инерции, прочности соответствующих химических связей. Относительное различие масс изотопов тем меньше, чем больше атомный номер элемента. У изотопов водорода оно составляет 100 % для дейтерия D (2H) и 200 % для трития Т (3H) по сравнению с протием Н (1H). Поэтому для водорода изотопные эффекты выражены наиболее сильно [19].
Существует 42 изотополога (комбинации различных атомов-изотопов дают набор молекул-изотопологов1) воды (включая стабильные и нестабильные изотопы водорода и кислорода). Из них тридцать три молекулы воды радиоактивные, и девять стабильных, устойчивых молекул воды.
Вероятность образования молекул с разным изотопным составом не одинакова. Самой распространенной является молекула с наименьшей массой, состоящая из водорода – 1 (протия) и кислорода – 16. Содержание других более тяжелых молекул в природе не превышает 0,23 % [19, 10], содержание изотопных модификаций водыв природе представлено в табл. 1.
Таблица 1
Содержание изотопных модификаций воды в природе
|
Молекулы воды |
Содержание, % |
|
Н218O |
0,205 |
|
HD16O |
0,015 |
|
HD18O |
6·10–5 |
|
HD17O |
1·10–6 |
|
D216O |
3·10–6 |
|
D218O |
9·10–9 |
|
D217O |
1·10–9 |
На рис. 6 показано, что количество 2Н в атмосферной влаге и в природных водах зависит от климата, близости региона к морям и ледникам, высоты над уровнем океана. В мировой практике принято выражать содержание дейтерия в ‰ или ppm. Ppm – это число монодейтерированнных
молекул воды на 1 миллион молекул, содержащих только легкий изотоп 1Н. По мере испарения воды с поверхности океана содержание дейтерия изменяется на 20 ppm.
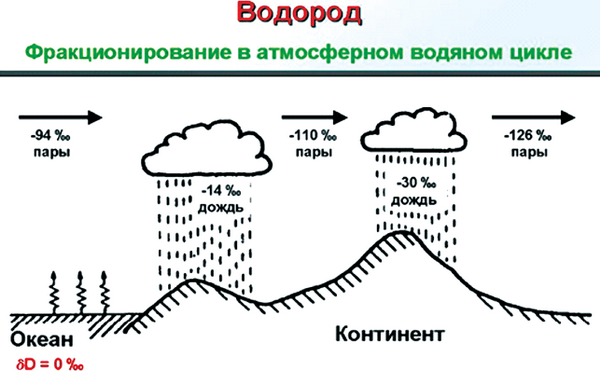
Рис. 6. Фракционирование водорода в атмосферном водяном цикле
В замкнутых водоемах тяжелой воды больше, так как по сравнению с обычной она испаряется менее интенсивно. Поэтому тяжелой воды больше в местностях с жарким климатом [22].
Обогащается дейтерием и поверхность океана на экваторе (155 ppm) и в тропиках, где свою лепту вносят частые атмосферные осадки, при образовании которых идут процессы конденсации воды из паровой фазы, а тяжелая вода конденсируется быстрее, чем легкая [23], следовательно, осадки обогащены тяжелой водой.
Самое низкое содержание 2Н в водяных парах над антарктическими льдами ≈ 90 ppm. Невелика доля дейтерия и во льдах Гренландии (126 ppm). Содержание дейтерия в природных водах различного происхождения показано в табл. 2 [24].
Стоит обратить внимание на то, что содержание дейтерия в природных водах Иркутской области ниже, чем в Европейской части России и в Европе. Так, D/Н в Байкале составляет 137,0 ppm, а в некоторых минеральных источниках – 132,0 ppm, в то время как содержание D аналогичных источниках в Европе не менее 145–150 ppm. Такие данные
могут использоваться при идентификации источника минеральных
и столовых вод (табл. 2).
Таблица 2
Содержание дейтерия в природных водах
|
Место отбора проб |
Содержание дейтерия, ррm |
|
Арктический бассейн |
110,1 |
|
Атлантический бассейн |
155,9 |
|
Индийский океан |
155,9 |
|
Тихий океан |
155,5 |
|
Антарктические льды (водяные пары) |
90,0 |
|
Гренландия (водяные пары) |
126,0 |
|
Центральная Европа |
140,0–150,0 |
|
Оз. Хабсугул (МНР) |
145,8 |
|
Оз. Хлоридное (Камчатка) |
142,8 |
|
Москва-река |
139,3 |
|
Аршан (источник), Республика Бурятия |
133,8 |
|
Мунок, ист.17 |
132,5 |
|
Оз. Байкал (Листвянка) |
137,5 |
Исходя из изотопного состава, выделяют легкую, тяжелую и полутяжелую воду.
Вода только с легкими изотопами в природе не встречается. Нулевая вода состоит из чистого легкого водорода и кислорода воздуха. Эта вода выбрана в качестве эталона: у нее очень постоянный состав. С ней удобно сравнивать воду неизвестного состава: определив разницу в плотности, легко найти содержание дейтерия. Формально протиевую воду называют легкой водой. Рабочим эталоном легкой воды считают смесь разновидностей воды состава 1H216O, 1H217O и 1H218O, взятых в том же соотношении, в котором присутствуют в воздухе соответствующие изотопы кислорода [7].
Тяжелая вода – это вода, в которой протий полностью замещен на дейтерий и представлена формулой D2О. Изотопный состав по кислороду в этой воде соответствует обычно составу кислорода воздуха. Плотность тяжелой воды 1104 кг/м3. Тяжелая вода кипит при более высокой и замерзает при более низкой температуре, чем легкая [20].
Полутяжелой называют воду со смешанными молекулами состава HDO. Она есть во всякой природной воде, но получить ее в чистом виде невозможно, потому что в воде всегда протекают реакции изотопного обмена. Атомы изотопов водорода очень подвижны и непрерывно переходят из одной молекулы в другую. Приготовить воду, средний состав которой будет соответствовать формуле полутяжелой воды, нетрудно. Но из-за реакции обмена она будет представлять собой смесь молекул с разным изотопным составом H2O, HDO, D2O [19].
Кроме всех перечисленных вод, еще существует тяжелокислородная вода с атомной массой кислорода 18 [7].
Изотопные модификации молекул воды оказывают различное действие на структуру воды. Например, происходит самоорганизация упорядоченной структуры приповерхностного слоя воды в результате ее стабилизации молекулами НDО, обладающими бóльшей энергией ассоциации по сравнению с молекулами Н2О [20].
