
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.1. Изложение уникальных свойств воды и льда при изучении курса физики
В настоящее время теме воды и льда в науке уделяется повышенное внимание. Достаточно отметить, что результаты последних исследований стекаются в открытый с 2004 г. центр по исследованию воды в Люксембурге, ширится число публикаций о воде как в научной, так и в научно-популярной литературе, проводятся различные конференции. Вместе с тем, студентам младших курсов, изучающим физику, удивительные физические свойства данных природных феноменов, как правило, почти не освещаются, что является, на наш взгляд, серьезным упущением [63].
Например, при рассмотрении теории теплоемкости следует заострить внимание обучаемых на том, что у воды наблюдается аномалия с теплоемкостью. Известно, что удельная теплоемкость металлов при плавлении или совсем не меняется (например, олово) или меняется незначительно (алюминий, серебро), или меняется на 10–13 % (золото, свинец). А у воды при 0 °С она равна 4,212 Дж/(г⋅К), что вдвое больше, чем у льда, у которого значение удельной теплоемкости составляет 2,122 Дж/(г⋅К). А ведь, что лед – это ведь тоже Н2О, при той же нулевой температуре. Возникает естественный вопрос о причинах данного явления.
Классическая теория теплоемкости объяснить этот факт не может. Она основывается на представлении о правильной кристаллической решетке льда, в узлах которой помещаются атомы, принимаемые за материальные точки, совершающие тепловые колебания около положений равновесия. Согласно классической теории, при изменении температуры средняя кинетическая и средняя потенциальная энергии колеблющегося атома изменяется на одну и ту же величину:
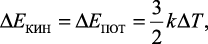 (1)
(1)
где k – постоянная Больцмана; Т – абсолютная температура.
Следовательно, изменение энергии атома, колеблющегося в узле кристаллической решетки, равно
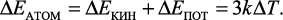 (2)
(2)
Изменение внутренней энергии одного моля вещества в кристаллическом состоянии можно представить так:
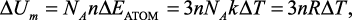 (3)
(3)
где NA – постоянная Авогадро; R – универсальная газовая постоянная; n – число атомов в молекуле.
Молярная теплоемкость при постоянном объеме определяется следующим образом:
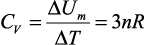 (4)
(4)
и от температуры не зависит, что не согласуется с экспериментом.
Оказывается, объяснение различия между теплоемкостями воды и льда возможно дать на основе квантовой теории теплоемкости, первый вариант которой предложил А. Эйнштейн в 1907 году в статье «Теория излучения Планка и теория удельной теплоемкости». Он рассматривал атомы кристаллической решетки как гармонические осцилляторы, совершающие тепловые колебания около положений равновесия с одной и той же частотой ν.
Принимая, согласно Планку, значение средней энергии осциллятора с тремя степенями свободы:
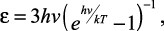 (5)
(5)
где h – постоянная Планка, Эйнштейн получил значения внутренней энергии одного моля вещества:
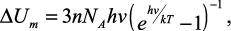 (6)
(6)
а для молярной теплоемкости при постоянном объеме:
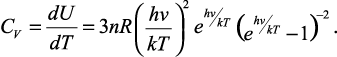 (7)
(7)
Как видно из формулы, молярная теплоемкость зависит от температуры, что подтверждает эксперимент. Нетрудно убедиться, что вблизи абсолютного нуля теплоемкость стремиться к нулю, но если выполняется условие kT >> hν, то теплоемкость С = 3nR, т.е. мы приходим к классическому пределу.
Теорию Эйнштейна независимо друг от друга уточнили в 1912 г. П. Дебай и Н. Борн. Согласно Дебаю, частицы в узлах кристаллической решетки колеблются не независимо друг от друга, а образуют систему стоячих волн, частоты которых меняются от нуля до некоторой максимальной частоты νmax. Исходя из этих соображений, П. Дебай получил более точное выражение для теплоемкости и показал, что данная величина меняется пропорционально кубу абсолютной температуры (а не по экспоненте, как следовало из теории Эйнштейна), что полностью согласуется с экспериментальными данными.
При изучении плотности различных тел, следует обратить внимание студентов на тот факт, что большинство веществ в кристаллическом состоянии плотнее своего расплава, а у льда плотность меньше, чем у воды при той же температуре. При нагревании воды от 0 до 4 °С ее плотность не уменьшается, а возрастает, и только при дальнейшем нагревании плотность убывает, как у всех веществ. При температуре плавления Т = 273,15 К = 0 °С у льда она составляет 916,8 кг/м3, у воды –
999,84 кг/м3. Чтобы стала понятной разница между этими значениями, необходимо показать и объяснить студентам особенности строения кристаллической решетки льда.
Элементарная ячейка льда представляет собой тетраэдр, в вершинах и в центре которого расположены отрицательные ионы кислорода, а по каждой линии О–О находится один протон Н. При этом протон,
оставаясь все время на линии О–О, примерно половину времени находится около «своего», а половину времени – около чужого атома кислорода (на рис. 7 светлые кружочки – атомы кислорода, черные – водорода). Так образуется довольно сильная водородная связь.
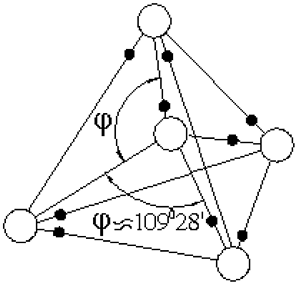
Рис. 7. Элементарная ячейка льда
Объединяясь, элементарные ячейки льда образуют трехмерную гексагональную структуру с координационным числом 4, т.е. каждая молекула связана с тремя молекулами своего слоя и одной молекулой соседнего слоя (рис. 8).
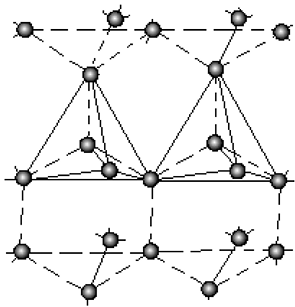
Рис. 8. Трехмерная гексагональная структура льда
Возникает ажурная кристаллическая структура с большим числом пустот (рис. 9), но достаточно жесткая (сжимаемость ~ 10–10 Па–1).
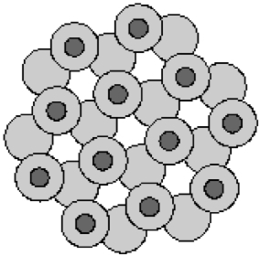
Рис. 9. Ажурная кристаллическая структура льда
При плавлении льда, лишь около 15 % связей разрывается, часть молекул воды заполняет пустоты, и координационное число возрастает до 4,4. При этом плотность возрастает примерно на 9 %, а жесткость структуры уменьшается (сжимаемость ~ 5⋅10–10 Па–1).
Далее следует поговорить о разумном устройстве природы на примере замерзания воды. Охлаждаясь, вода становится тяжелее и перемещается вниз, при этом, более теплая вода поднимается наверх. Но когда вода достигает точки замерзания, то происходит обратный процесс – теперь становится легче и поднимается более холодная вода, которая превращается в лед и держится на поверхности. Лед действует как изолятор, предохраняющий от замерзания воду подо льдом и защищающий подводную жизнь. Если бы этого не было, то каждую зиму все больше льда опускалось бы на дно, где наступающим летом солнечные лучи не могли бы растопить его. Со временем Земля превратилась бы в суровую, неблагоприятную для жизни ледяную планету. И только благодаря уникальным свойствам воды и льда этого не происходит.
Рассмотренный материал позволит обсудить со студентами необычные свойства воды, которые объясняются, в том числе, способностью ее молекул образовывать межмолекулярные ассоциаты как за счет ориентационных, индукционных и дисперсионных взаимодействий (сил Ван-дер-Ваальса), так и за счет водородных связей. Известно, что благодаря этим взаимодействиям молекулы воды способны образовывать ассоциаты, не имеющие упорядоченной структуры (случайные), так и кластеры – ассоциаты, имеющие определенную структуру [63].
