
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.2.5. Модель химической связи
Природа химической связи
В определенных условиях часть вещества одного атома (т.е. часть вихря, состоящего из «темных нейтрино») объединяется с вихрем другого атома. Так как вихри взаимодействующих атомов имеют центростремительное ускорение, направленное в противоположные стороны, то вихрь левого атома «тянет» влево часть вихря правого атома. Соответственно, вихрь правого атома «тянет» вправо часть вихря левого атома (рис. 2.19). Вследствие этого взаимодействия возникает сцепление двух вихрей-атомов, определяемое как химическая связь.
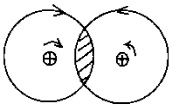
Рис. 2.19. Схема химической связи двух атомов
Аналогична модель природы ядерного взаимодействия, но сцепление происходит на уровне ядер. При этом центр вращения вихрей смещается относительно друг друга.
Таким образом, «жидкостная» вихревая модель не противоречит квантово-механической модели атома о «размазанности» электрона.
Допущения и расчетные формулы
1. Химическая связь в монокристалле определяется для элементарной атомной ячейки, которая схематично представлена на рис. 2.20.
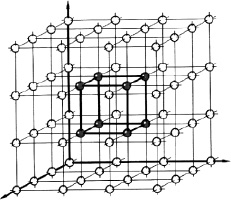
Рис. 2.20. Схема расположения ячейки в кристаллической решетке
2. Природой химической связи является взаимодействие электронных оболочек атомов (рис. 2.19).
3. Применяется единая модель расчета кулоновской силы (для силы и модуля упругости)
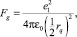
где rq = r100 – расстояние между взаимодействующими зарядами; r100 – расстояние между ближайшими соседями-атомами.
4. В случае химической связи центр вращения масс находится между центрами взаимодействующих масс. Поэтому в формуле всемирного закона тяготения
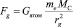
расстояние между центрами взаимодействующих масс определяется как rg = а0 /2.
5. Современными техническими средствами радиусы стационарных орбит атомов измерить невозможно. Для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально [70]. Поэтому принимается, что радиус атома изменяемая (варьируемая) величина, а расстояние между атомами (период кристаллической решетки) а0 – физическая константа, определяемая экспериментально, то есть
rатом = var; а0 = const.
6. Поскольку rатом = var, то радиус атома подбирается до выполнения условия Fс ≈ Fq ≈ Fg. С другой стороны, условие Fс ≈ Fq ≈ Fg определяет возможность расчета действительного значения радиуса атома.
7. Доля взаимодействующей массы (взаимодействующих электронов в объемной доле взаимодействующих сфер) mдоля определяется как
mдоля = Vдоля⋅М_e,
где М_e = me⋅Z – масса электронной оболочки; me – масса электрона; Z – атомный заряд элемента.
