
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ГНЕЗДНАЯ АЛОПЕЦИЯ: ЛИНИКО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ И МИКРОЭЛЕМЕНТНЫЙ СТАТУС ПАЦИЕНТОВ
Николаева Т. В., Воронина Л. Г., Сетко Н. П., Пострелко М. Д.,
4. ГЕНЕТИЧЕСКИЕ АСПЕКТЫ ГНЕЗДНОЙ АЛОПЕЦИИ ПО ДАННЫМ РЕПЛИКАТИВНОГО АССОЦИАТИВНОГО АНАЛИЗА НА ПРИМЕРЕ РОССИЙСКОЙ ПОПУЛЯЦИИ
Для проведения репликативного исследования на основании анализа данных Каталога полногеномных ассоциативных исследований (Genome-Wide Association Studies, GWAS), поддерживаемого Национальным институтом геномных исследований США [http: www.genome.gov/gwastudies], было отобрано 8 однонуклеотидных полиморфизмов (ОНП) генов, ассоциированных по данным зарубежных исследователей, с ГА (табл. 5) [69].
Таблица 5
Полиморфные маркеры генов, ассоциированных
с гнездной алопецией (по данным GWAS)
|
ОНП |
Обозначение гена |
Белковый продукт гена |
Хромосомная локализация гена |
|
rs9479482 |
ULBP3/ ULBP6 |
UL16-связывающий белок 3 (Q9BZM4) / UL16-связывающий белок 6 |
6q25.1 |
|
rs1024161 |
CTLA4/ICOS |
Белок 4, ассоциированный с цитотоксическими Т-лимфоцитами (P16410) / Индуцируемый Т-клеточный костимулятор (Q9Y6W8) |
2q33.2 |
|
rs694739 |
PRDX5 |
Пероксиредоксин-5 (P30044) |
11q13.1 |
|
rs7682241 |
IL2/IL21 |
Интерлейкин 2 (P60568) / Интерлейкин 21 (Q9HBE4) |
4q27 |
|
rs1701704 |
IKZF4 |
Цинк-пальцевый белок Eos семейства транс- |
12q13.2 |
|
rs3118470 |
IL2RA |
альфа-цепь рецептора интерлейкина-2 (P01589) |
10p15.1 |
|
rs9275572 |
HLA-DQA2 |
Антиген главного комплекса гистосовместимости II класса DQ альфа 2 (P01906) |
6p21.32 |
|
rs10760706 |
STX17 |
Синтаксин-17 (P56962) |
9q31.1 |
Анализ данных табл. 5 показал, что распределение генотипов rs9275572 гена HLA-DQA2 как у здоровых пробандов группы сравнения (p = 0,03), так и у пациентов с ГА (p = 0,008) не соответствовало РХВ. Кроме того, у пациентов с ГА распределение генотипов rs1701704 гена IKZF4 и rs10760706 гена STX17 также отклонялось от РХВ, достигнутые уровни значимости различий (p) наблюдаемого распределения генотипов от ожидаемого при РХВ соответственно были равны 0,02 и 0,007. Согласно мнению ряда исследователей причинами отклонения от РХВ могут быть ошибки генотипирования [27], популяционная стратификация или ассоциация с заболеванием [42]. Последнее может быть возможным объяснением отклонения от РХВ генотипов rs1701704 гена IKZF4 и rs10760706 гена STX17 в группе пациентов. Вместе с тем, вероятной причиной несоответствия РХВ распределения генотипов rs9275572 гена HLA-DQA2 у пробандов обеих групп исследования могут быть ошибки генотипирования, что явилось основанием для исключения полиморфного маркера гена HLA-DQA2 из дальнейшего анализа.
Стандартными моделями для поиска ассоциации между генотипом и фенотипом являются общая, мультипликативная и аддитивная генетические модели [54]. Аддитивная генетическая модель применима к исследованиям, ограниченным небольшими выборками и при необходимости анализа нескольких признаков одновременно [12]. В настоящем исследовании для определения ассоциаций генетических маркеров с ГА применялись мультипликативная и общая генетические модели.
Мультипликативная генетическая модель представляет собой тестирование ассоциации аллелей генов с фенотипом болезни. Ограничением для ее использования является несоответствие распределения полиморфизмов генов РХВ как в выборке пациентов, так и в контрольной выборке [54], поэтому из данного анализа были исключены полиморфные маркеры rs1701704 гена IKZF4 и rs10760706 гена STX17. Использование мультипликативной генетической модели (табл. 6) выявило статистически значимое увеличение частот аллелей двух полиморфных маркеров ГА.
Установлено, что среди пациентов с ГА носительство минорного аллеля А полиморфного маркера rs1024161 гена CTLA4 в 1,4 раза выше, чем среди здоровых лиц (OR = 1,91; 95 % ДИ 1,29–2,83; p = 0,001). Частота мажорного аллеля А однонуклеотидного полиморфизма rs694739 гена PRDX5 у пациентов с ГА в 1,2 раза выше, чем у здоровых пробандов (OR = 1,75; 95 % ДИ 1,16–2,66; p = 0,008). Это свидетельствует об ассоциации аллелей указанных ОНП генов CTLA4 и PRDX5 с ГА в исследуемой выборке пациентов.
Таблица 6
Мультипликативная генетическая модель гнездной алопеции
|
ОНП, ген |
Аллель |
Частоты аллелей |
χ2; df = 1 |
p |
OR |
||
|
Пациенты |
Группа сравнения |
Значение |
95 % ДИ |
||||
|
rs9479482, ULBP3/ ULBP6 |
A* |
0,533 |
0,550 |
0,11 |
0,73 |
0,94 |
0,63–1,38 |
|
G |
0,467 |
0,450 |
1,07 |
0,72–1,58 |
|||
|
rs1024161, CTLA4/ ICOS |
G |
0,471 |
0,630 |
10,4 |
0,001** |
0,52 |
0,35–0,78 |
|
A |
0,529 |
0,370 |
1,91 |
1,29–2,83 |
|||
|
rs694739, PRDX5 |
A* |
0,729 |
0,605 |
7,06 |
0,008** |
1,75 |
1,16–2,66 |
|
G |
0,271 |
0,395 |
0,57 |
0,38–0,86 |
|||
|
rs7682241, IL2/IL21 |
C |
0,548 |
0,635 |
3,23 |
0,07 |
0,70 |
0,47–1,03 |
|
A |
0,452 |
0,365 |
1,44 |
0,97–2,14 |
|||
|
rs3118470, IKZF4 |
А |
0,614 |
0,695 |
2,95 |
0,09 |
0,70 |
0,46–1,05 |
|
G |
0,386 |
0,305 |
1,43 |
0,95–2,16 |
|||
Примечание. * – по данным GWAS рисковым является мажорный аллель; ** – статистическая значимость различий p < 0,01; OR – отношение шансов; ДИ – доверительный интервал.
Общая генетическая модель позволяет анализировать ассоциацию между генотипом пробандов и их фенотипом, не требуя соблюдения РХВ в исследуемых выборках [54]. Анализ данных табл. 7, описывающих общую генетическую модель ГА, свидетельствовал о наличии ассоциации с ГА однонуклеотидных полиморфизмов rs1024161 гена CTLA4 (χ2 = 13,74; p = 0,001), rs694739 гена PRDX5 (χ2 = 6,47; p = 0,04), rs1701704 гена IKZF4 (χ2 = 20,66; p = 0,00003), rs10760706 гена STX17 (χ2 = 16,82; p = 0,0002).
Таблица 7
Общая генетическая модель гнездной алопеции
|
Ген |
Генотип |
Частоты генотипов |
χ2; df = 2 |
p |
OR |
||
|
Пациенты |
Группа |
Значение |
95 % ДИ |
||||
|
ULBP3/ ULBP6 |
A/A* |
0,295 |
0,260 |
2,51 |
0,28 |
1,19 |
0,65–2,20 |
|
G/A |
0,476 |
0,580 |
0,66 |
0,38–1,14 |
|||
|
G/G |
0,229 |
0,160 |
1,56 |
0,77–3,14 |
|||
|
CTLA4/ ICOS |
G/G |
0,267 |
0,370 |
13,74 |
0,001** |
0,62 |
0,34–1,12 |
|
A/G |
0,410 |
0,520 |
0,64 |
0,37–1,11 |
|||
|
A/A |
0,324 |
0,110 |
3,87 |
1,38–8,19 |
|||
|
PRDX5 |
A/A* |
0,562 |
0,390 |
6,47 |
0,04** |
2,01 |
1,15–3,50 |
|
G/A |
0,333 |
0,430 |
0,66 |
0,38–1,17 |
|||
|
G/G |
0,105 |
0,180 |
0,53 |
0,24–1,19 |
|||
|
IL2/IL21 |
C/C |
0,257 |
0,390 |
4,23 |
0,12 |
0,54 |
0,30–0,98 |
|
A/C |
0,581 |
0,490 |
1,44 |
0,83–2,50 |
|||
|
A/A |
0,162 |
0,120 |
1,42 |
0,64–3,14 |
|||
|
IKZF4 |
A/A |
0,210 |
0,510 |
20,66 |
0,00003** |
0,25 |
0,14–0,47 |
|
G/A |
0,610 |
0,350 |
2,90 |
1,64–5,12 |
|||
|
G/G |
0,181 |
0,140 |
1,36 |
0,64–2,88 |
|||
|
IL2RA |
A/A |
0,390 |
0,520 |
3,47 |
0,18 |
0,59 |
0,34–1,03 |
|
G/A |
0,448 |
0,350 |
1,50 |
0,86–2,64 |
|||
|
G/G |
0,162 |
0,130 |
1,29 |
0,59–2,82 |
|||
|
STX17 |
A/A |
0,381 |
0,460 |
16,82 |
0,0002** |
0,72 |
0,41–1,26 |
|
G/A |
0,362 |
0,490 |
0,59 |
0,34–1,03 |
|||
|
G/G |
0,257 |
0,050 |
6,58 |
2,42–17,88 |
|||
Примечание. * – по данным GWAS рисковым является мажорный аллель; ** – статистическая значимость различий p < 0,01; OR – отношение шансов; ДИ – доверительный интервал.
Установлено, что наиболее сильный вклад в ассоциацию с фенотипом ГА проявляют отдельные генотипы, частоты которых были статистически значимо выше у пациентов по сравнению со здоровыми пробандами. Так, генотип G/G однонуклеотидного полиморфизма rs10760706 гена STX17 у пациентов встречался в 5,1 раза чаще, чем у здоровых лиц (OR = 6,58; 95 % ДИ 2,42–17,88). Среди пациентов с ГА носительство гомозиготы А/А полиморфного маркера rs1024161 гена CTLA4 было в 2,9 раза больше, чем среди здоровых пробандов (OR = 3,87; 95 % ДИ 1,38–8,19), при этом носители мажорного аллеля G, вероятно, имели пониженный риск развития ГА. У пациентов, страдающих ГА, частота носительства гомозиготы по мажорному аллелю А однонуклеотидного полиморфизма rs694739 гена PRDX5 была в 1,4 выше, чем у лиц группы сравнения (OR = 2,01; 95 % ДИ 1,15–3,50). Носительство генотипов G/A и G/G полиморфного маркера rs1701704 гена IKZF4 у пациентов в 1,7 и 1,3 раза соответственно было выше, чем у здоровых пробандов (OR = 1,50; 95 % ДИ 0,86–2,64 и OR = 1,29; 95 % ДИ 0,59–2,82 соответственно).
Данные, полученные с помощью мультипликативной и общей генетических моделей, совпали относительно выявленных ассоциаций с ГА однонуклеотидных полиморфизмов rs1024161 гена CTLA4 и rs694739 гена PRDX5. Дополнительные ассоциации с ГА были определены на генотипическом уровне для полиморфных маркеров rs1701704 гена IKZF4 и rs10760706 гена STX17.
В настоящем исследовании не подтверждены ранее установленные методом GWAS ассоциации ГА с однонуклеотидными полиморфизмами rs9479482 гена ULBP3/ULBP6, rs7682241 гена IL2/IL21 и rs3118470 гена IL2RA, что может объясняться как относительно малой численностью исследуемых групп, так и особенностями исследуемой популяции в отношении ассоциаций ген – признак [48].
На основе проведенного логистического регрессионного анализа была построена математическая модель ГА, описываемая формулой (1). Она представляет собой зависимость бинарной переменной от совокупности независимых признаков – шести значимых показателей, характеризующих генотипы участников исследования.
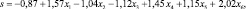 (1)
(1)
|
где s – |
показатель экспоненты; |
|
–0,87 – |
свободный член, не имеющий клинической интерпретации; |
|
х1 – |
признак гомозиготы по мажорному аллелю/гомозиготы по минорному аллелю полиморфизма гена CTLA4; |
|
х2 – |
признак гетерозиготности/гомозиготности полиморфизма гена PRDX5; |
|
х3 – |
признак гомозиготы по минорному аллелю/гомозиготы по мажорному аллелю полиморфизма гена PRDX5; |
|
х4 – |
признак гетерозиготности/гомозиготности полиморфизма гена IKZF4; |
|
х5 – |
признак гомозиготы по минорному аллелю/гомозиготы по мажорному аллелю полиморфизма гена IKZF4; |
|
х6 – |
признак гомозиготы по минорному аллелю/гомозиготы по мажорному аллелю полиморфизма гена STX17. |
Вероятность наличия ГА у обследуемых (y) рассчитана по форму-
ле (2) бинарной логистической регрессии, имеющей вид:
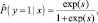 (2)
(2)
|
где s – |
показатель экспоненты, рассчитывающийся по формуле (1); |
|
|
вероятность. |
В том случае, если вероятность  менее 0,5, то участник исследования имел низкий риск развития ГА, если более 0,5 – принадлежал к группе высокого риска развития ГА. На примере генотипа пациента 28 лет, страдающего очаговой формой гнездной алопеции, рассчитаем риск формирования заболевания (табл. 8).
менее 0,5, то участник исследования имел низкий риск развития ГА, если более 0,5 – принадлежал к группе высокого риска развития ГА. На примере генотипа пациента 28 лет, страдающего очаговой формой гнездной алопеции, рассчитаем риск формирования заболевания (табл. 8).
Таблица 8
|
Ген |
Полиморфизм |
Генотип |
Рисковый аллель |
|
CTLA4 |
rs1024161 |
A/G |
A |
|
PRDX5 |
rs694739 |
A/A |
A* |
|
IKZF4 |
rs1701704 |
A/G |
G |
|
STX17 |
rs10760706 |
G/G |
G |
Примечание. * – рисковым является мажорный аллель.
Для расчета вероятности развития ГА выявленные у обследуемого генотипы были приведены в соответствие бинарным переменным, приняв следующие значения:
х1 – обследуемый относится к гетерозиготе по полиморфизму гена CTLA4 (не является гомозиготой), переменная принимает значение 0;
х2 – обследуемый относится к гомозиготе по полиморфизму гена PRDX5, переменная принимает значение 0;
х3 – обследуемый относится к гомозиготе по мажорному аллелю полиморфизма гена PRDX5, переменная принимает значение 0;
х4 – обследуемый относится к гетерозиготе по полиморфизму гена IKZF4, переменная принимает значение 1;
х5 – обследуемый относится к гетерозиготе (не является гомозиготой) по полиморфизму гена IKZF4, переменная принимает значение 0;
х6 – обследуемый относится к гомозиготе по минорному аллелю полиморфизма гена STX17 , переменная принимает значение 1.
Путем подставления значения переменных в уравнение (1) был рассчитан показатель экспоненты:
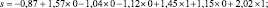
s = 2,6.
Рассчитано значение экспоненты с использованием программы «Microsoft Excel 2003»:
exp(s) = 13,46.
Вычислена вероятность  по формуле (2):
по формуле (2):
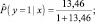
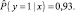
С учетом полученного значения вероятности, обследуемый относится к группе риска по развитию ГА.
Анализ полученной логит-модели свидетельствует о том, что значимое влияние на возникновение ГА оказывают полиморфизм rs1024161 гена CTLA4, полиморфизм rs694739 гена PRDX5, полиморфизм rs1701704 гена IKZF4 и полиморфизм rs10760706 гена STX17. По знакам коэффициентов логистической регрессии можно сделать вывод, о том, что увеличению вероятности развития заболевания способствуют гомозигота по минорному аллелю полиморфизма rs1024161 гена CTLA4, гетерозигота и гомозигота по минорному аллелю полиморфизма rs1701704 гена IKZF4, гомозигота по минорному аллелю полиморфизма rs10760706 гена STX17. Напротив, гетерозигота и гомозигота по минорному аллелю полиморфизма rs694739 гена PRDX5 способствуют снижению вероятности развития ГА. Чувствительность модели, рассчитанная как отношение истинно-положительных результатов к общему количеству пациентов, составила 70,48 %. Специфичность, являющаяся отношением истинно-отрицательных результатов к числу лиц контрольной группы, равна 72,0 %. Для численного выражения качества модели использован показатель площади под ROC-кривой AUC (Area Under Curve), которая в данном случае составляет 0,7831. Согласно экспертной шкале для значений AUC, интервал от 0,7 до 0,8 соответствует хорошему качеству модели [7].
Известно, что в основе большинства биологических процессов лежат взаимодействия между белками [21]. Анализ белок-белковых взаимодействий, присущих тому или иному заболеванию, является важным инструментом в установлении механизмов его развития [21]. Для проведения анализа взаимодействия белковых продуктов генов, ассоциированных с ГА, использован ресурс STRING (Search Tool for Retrieval of Interacting Gines/Proteins) [4]. Проведенный анализ позволил выявить две группы взаимодействующих белковых продуктов генов, ассоциированных с ГА. Первая из них была представлена взаимодействующими белковыми продуктами генов CTLA4, ICOS, IL2, IL2RA и IL21, осуществляющих регуляцию деятельности иммунной системы. Вторая – состояла из взаимосвязанных белковых продуктов генов PRDX5, ULBP3 и STX17, которые по данным литературы характеризовались повышенной экспрессией в пораженной коже волосистой части головы пациентов с ГА [45, 63]. В то время как взаимосвязь белковых продуктов генов PRDX5, ULBP3 и STX17 в основном объяснялась совместным упоминанием в отдельных работах зарубежных авторов [49, 69], белки генов CTLA4, ICOS, IL2, IL2RA и IL2, как показал дальнейший анализ с использованием базы данных KEGG (Kioto Encyclopedia of Genes and Genomes) [3], были объединены общими сигнальными путями (KEGG-путями) (табл. 9).
Таблица 9
Вовлеченность генов, ассоциированных
с гнездной алопецией в метаболические пути (KEGG-пути)
|
Номер KEGG-пути |
Наименование KEGG-пути |
Вовлеченные гены |
p (FDR)* |
|
hsa04660 |
Сигнальный путь Т-клеточного рецептора |
CTLA4, ICOS, IL2 |
0,0009 |
|
hsa04514 |
Молекулы клеточной адгезии |
HLA-DQA2, CTLA4, ICOS |
0,002 |
|
hsa04630 |
Jak-STAT сигнальный путь |
IL2RA, IL2, IL21 |
0,002 |
|
hsa04060 |
Цитокин-цитокиновое рецепторное взаимодействие |
IL2RA, IL2, IL21 |
0,006 |
|
hsa05320 |
Аутоиммунные заболевания щитовидной железы |
IL2, HLA-DQA2, CTLA4 |
0,00022 |
|
hsa04940 |
Сахарный диабет I типа |
IL2, HLA-DQA2 |
0,0053 |
|
hsa05321 |
Воспалительные заболевания кишечника |
IL2, IL21, HLA-DQA2 |
0,0003 |
|
hsa05323 |
Ревматоидный артрит |
HLA-DQA2, CTLA4 |
0,018 |
Примечание. Скорректированный уровнем значимости путем вычисления ожидаемой доли ложных отклонений (FDR, false discovery rate) и пороговым значением р < 0,05.
Возможно, общность метаболических путей объясняет частое сочетание ГА с указанными выше АИЗ. Например, оценка функционального состояния щитовидной железы у обследованной группы пациентов с ГА показала, что медианы содержания показателей, представленных в табл. 10, не выходили за рамки референсных интервалов, однако уровень тиреотропного гормона гипофиза (ТТГ) превышал физиологическую норму у 18,4 % обследованных, тироксина свободного (Т4 своб.) – у 4,3 %, трийодтиронина свободного (Т3 своб.) – у 36,4 %, концентрация антител к тиреопероксидазе (АТ к ТПО) – у 32,3 % пациентов с гнездной алопецией. Ультразвуковое исследование щитовидной железы у 39,6 % пациентов с ГА позволило установить разнообразные изменения ее структуры и объема. Так, у 12,5 % – признаки аутоиммунного тиреоидита, у 8,3 % – узла щитовидной железы.
Таблица 10
Показатели содержания гормонов щитовидной железы и антител к тиреопероксидазе в сыворотке крови пациентов с гнездной алопецией
|
Показатель |
Содержание в сыворотке крови |
Референсный интервал |
|
|
Ме [Q25; Q75] |
Минимальное и максимальное значение |
||
|
ТТГ, мкМЕ/мл |
2,35 [1,4; 3,01] |
0,27–8,9 |
0,4–4,0 |
|
Т4 своб., пмоль/л |
15,1 [12,5; 16,8] |
0,89–193,03 |
10,0–25,0 |
|
Т3 своб., пмоль/л |
2,17 [1,71; 3,76] |
1,0–12,9 |
1,0–2,8 |
|
АТ к ТПО, Ед/мл |
17,66 [1,8; 77,2] |
0,39–640,0 |
Не более 34 |
Изменение объема щитовидной железы диагностировано у 18,5 % пациентов: гипоплазия была выявлена в 10,4 % случаев, гиперплазия – в 6,3 % случаев, тиромегалия – в 2,1 % случаев. При этом сочетание ультразвуковых признаков изменения паренхимы и объема щитовидной железы было зарегистрировано у 6,3 % пациентов. В 60,4 % случаев ультразвуковых изменений щитовидной железы обнаружено не было. По данным проведенного исследования диагностирован аутоиммунный тиреоидит у 22,2 % пациентов и у 11,0 % – диффузный токсический зоб.
 –
–