
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
9.2. Неконтрацептивные эффекты ГК
 Огромное преимущество —не быть однообразным
Огромное преимущество —не быть однообразным
Оноре де Бальзак
Гормональная контрацепция предоставляет современной женщине уникальную возможность сохранения репродуктивного здоровья, поскольку, по сути, заменяет собой природный механизм подавления овуляции, подобно тому, как это происходит во время беременности и лактации.
Благодаря этому ГК обеспечивают не только контрацепцию, но и лечебный и протективный эффекты, что является весомым фактором при принятии решения о методе предупреждения беременности.
9.2.1. Неконтрацептивные эффекты – фактор повышения приверженности к гормональным контрацептивам
Было установлено, что, когда выбранный метод контрацепции отвечает ожиданиям женщины, и она получает значительное физическое и психологическое облегчение в связи с симптомами сопутствующих состояний, долгосрочная приверженность к препарату довольно высока, а побочные эффекты воспринимаются как незначительные [Nappi R.E. et al., 2009].
Улучшение качества жизни женщин, принимающих КОК, отмечается для большинства низко- и микродозированных средств, которые различаются незначительно в зависимости от гестагенного компонента.
Преимущества новых контрацептивных технологий, связанные с новыми прогестагенами, другими способами введения гормонов, пролонгированием действия позволяют повысить приверженность и комплаентность ГК, уменьшить частоту побочных эффектов, получить дополнительные неконтрацептивные преимущества.
9.2.2. Данные клинических исследований о неконтрацептивных эффектах ГК
Нарушение менструального цикла
Нарушение менструального цикла (НМЦ) – одна из самых частых причин обращения женщины к врачу акушеру-гинекологу. По данным разных авторов, в той или иной мере оно проявляется у 35% гинекологических пациентов. Кроме того, у более чем 70% женщин в течение жизни бывают те или иные нарушения.
Для нарушения менструального цикла характерны следующие клинические проявления:
- нерегулярность цикла,
- болезненность,
- обильные кровотечения.
Нерегулярные месячные – один из самых частых симптомов большинства гинекологических заболеваний, так же имеющий место и при экстрагенитальных заболеваниях у женщин.
Другим главным проявлением нарушения менструального цикла является кровотечение, характер и объем которого может сильно варьировать. Нередко кровотечение во время и вне месячных не имеют в своей основе какого-либо органического изменения, и в данном случае говорят о дисфункциональных маточных кровотечениях.
Лечебный эффект ГК, так же как и контрацептивный, обусловлен одним и тем же механизмом действия, основанным на подавлении овуляции в результате снижения циклической секреции гонадотропинов. Учитывая то, что механизм действия ГК на отдельные звенья репродуктивной системы неоднозначен и зависит от вида и дозы препаратов, клинические аспекты их применения также различны.
При применении синтетических прогестинов с контрацептивной целью в основном учитывается центральный механизм их действия, выражающийся в подавлении овуляции. Что касается использования ГК с лечебной целью, важным механизмом является их периферическое действие, выражающееся в подавлении пролиферации эндометрия, некрозе гиперплазированной железистой ткани эндометрия (гиперпластические процессы эндометрия, дисфункциональные маточные кровотечения, эндометриоз, дисгормональные заболевания молочных желез).
А. Нарушение цикличности менструаций
Нормальные месячные имеют следующие характеристики:
- продолжительность менструации составляет 2-7 дней;
- длительность месячного цикла – от 21 до 35 дней;
- объем менструальной кровопотери – 20-80 мл;
- менструации регулярные и безболезненные.
Как правило, месячные устанавливаются в возрасте от 12 до 14 лет и чаще всего в течение одного года после менархе становятся регулярными. Реже они приобретают регулярный характер после первой беременности. Периодические отклонения от нормы возможны, в рамках нескольких дней.
Отмечается, что менструальный цикл человека характеризуется средним интервалом 28 дней между двумя менструациями, при этом наблюдается значительная естественная изменчивость его продолжительности, даже среди женщин, которые считают, что они имеют «регулярные» циклы. Почти половина женщин, которые утверждали, что имеют постоянную продолжительность цикла, на самом деле имели его длину в диапазоне ±7 дней. Средняя продолжительность циклов с разницей не более 2-х дней имеет место у 62% женщин (при условии, что большинство женщин могут точно описать их продолжительность). Результаты обследования большого числа женщин 20–35-летнего возраста свидетельствуют о том, что примерно у 90% женщин менструальные циклы регулярные и имеют продолжительность в среднем 29,4±3,2 дня.
Таким образом, если месячные в конкретный цикл наступают на несколько дней раньше или позже, то говорить о нарушении цикла было бы не правильно. Если перерыв между месячными составляет 40-60 дней или же, наоборот, он менее 21 дня, и таким образом, месячные протекают у данной женщины длительное время – можно говорить о нерегулярности цикла.
Положительные эффекты ГК в отношении контроля менструального цикла позволяют использовать эти препараты в качестве терапевтических средств при лечении нарушений ритма менструаций.
Пациентки, нуждающиеся в регуляции менструального цикла, могут использовать любые низкодозированные монофазные КОК, содержащие прогестин, обладающий высокой прогестагенной активностью.
В исследовании Baumgaertner S. et al. (2004) с участием 5823 женщин было показано, что НоваРинг способствует восстановлению регулярного цикла: до использования НоваРинга у 16,6% женщин наблюдались нерегулярные кровянистые выделения, к 6 циклу – только у 2,8% женщин (рис. 9.3).
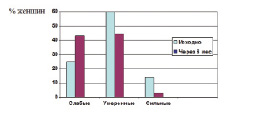
Рис. 9.3. Объем менструальной кровопотери у женщин (n=5823), применявших НоваРинг (Baumgaertner S. et al. (2004)
Б. Меноррагия
Меноррагиями страдают около 15% женщин репродуктивного возраста (Прилепская В.Н. с соавт., 2006).
В настоящем разделе рассматривается лечение меноррагии, представляющее собой овуляторное кровотечение, которое происходит при нормальных, регулярных (каждые 22-35 дней) менструациях, но отличающихся чрезмерным объемом (более 80 мл) и продолжительностью (более 7 дней). Другие функциональные и органические изменения должны быть исключены, так как требуют патогенетического лечения.
Bitzer J. et al. (2015) отмечают эффективность следующих средств для лечения меноррагий в порядке убывания: (1) ЛНГ-ВМС, (2) применение комбинированных ГК (оральных или трансвагинальных), (3) транексамовая кислота и нестероидные противовоспалительные средства и (4) длительный курс пероральных гестагенов (≥3 недель в цикл).
По мнению ряда исследователей, «Мирена» является средством «первого выбора» и успешно применяется при меноррагиях, уменьшая потерю крови на 97% в течение 12 мес и наиболее эффективна по сравнению с другими консервативными методами лечения меноррагии (Andersson J. et al., 1990; Григорьева В.А. с соавт., 2004).
Еще в 1997 г. J. Barrington et al. оценили влияние ЛНГ-ВМС Мирена на меноррагию. Пятьдесят женщин находились в ожидании оперативного вмешательства (гистерэктомии или трансцервикальной резекции эндометрия), поскольку к этому времени все консервативные методы лечения были исчерпаны. Этим женщинам было предложено ввести ЛНГ-ВМС на период ожидания операции. Через 3 мес после введения ВМС у 74% женщин значительно уменьшился объем кровопотери, к концу года использования ЛНГ-ВМС у 82% женщин отмечен выраженный положительный эффект, и все они отказались от хирургического лечения.
Клинический опыт в течение нескольких десятилетий свидетельствует о месте КОК в лечении тяжелых менструальных кровотечений для пациентов, которые требуют контрацепции, но не желают использовать ЛНГ-ВМС (Kiley J.W. et al., 2011).
Механизм действия КОК связан с уменьшением менструальной кровопотери за счет ограничения пролиферации эндометрия (National Collaborating Centre…, 2007.).
В небольших исследованиях было показано уменьшение менструального кровотечения на 43% (Fraser I..S. et al., 1991), а его объем снизился с 60,2 мл до 33,7 мл в течение 6 месяцев (Larsson G. et al., 1992).
Твердые доказательства эффективности КОК обеспечиваются двумя рандомизированными исследованиями КОК, содержащих эстрадиола валерат и диеногест (Jensen J.T. et al., 2011; Fraser I.S. et al., 2011). Уменьшение кровопотери колебалась от 60% до 70% по сравнению с группой плацебо. Также отмечено увеличение содержания в крови гемоглобина, гематокрита, ферритина. В обзоре нескольких крупных многоцентровых исследований снижение менструальной кровопотери было достигнуто на 80% у 46% женщин в группе E2В/ДНГ и только у 2% женщин в группе плацебо (Rafie S. et al., 2013).
Менее частые менструации или аменорея могут быть достигнуты путем использования расширенных схем, однако нет ни одного исследования доказывающего, что этот режим введения превосходит циклическое использование КОК для лечения тяжелых менструальных кровотечений.
Увеличение количества активных таблеток в упаковке КОК может уменьшить объем кровопотери. В исследовании, где 90 женщин были рандомизированы в 28-дневный цикл с 21 активных таблеток или 49-дневного цикла с 42 активных таблеток, женщины, принимавшие 42 активных таблетки имели меньше дней кровотечений, чем женщины, использовавшие традиционную 28-дневную схему. Подавление овуляции таблетками обеспечивает также профилактику кровоизлияния в желтое тело яичника у этих женщин (Miller L. et al., 2001).
КОК может быть также вариантом лечения женщин, которые имеют ановуляторные менструальные циклы, вызывающие метроррагию, менометроррагию и полименоррею (ACOG Practice Bulletin No. 110…, 2010). При этом КОК предотвращает развитие гиперплазии и рака эндометрия (Davis A. et al., 2000).
Baumgaertner S. et al. (2004) показано, что НоваРинг уменьшает длительность и объем менструаций: до исследования у 13,1% женщин объем менструальной кровопотери был высоким, к 6 циклу использования только у 2,4% женщин встречались обильные кровотечения. Регулярные кровотечения были в 98,5% циклах, средней продолжительностью от 4,5 до 5,2 дней (2322 женщин из США, Канады и Европы, 23298 циклов) (Dieben T.O.M. et al., 2002).
В исследовании, проведенном с целью обобщенного анализа данных о характере кровотечений при использовании препарата Импланон, полученных в 11 клинических исследованиях с участием 923 здоровых женщин в возрасте от 18 до 40 лет и использовавших препарат минимум на протяжении 2 лет, было показано, что у 77% женщин симптомы полностью купировались, и еще у 6% – наблюдалось уменьшение степени выраженности симптомов (Mansour D. et al., 2008).
Средства, содержащие только прогестерон, могут использоваться женщинами, которые имеют венозную тромбоэмболию в анамнезе или являются носителями фактора V Лейдена.
В. Дисменорея
Дисменорея – циклический патологический процесс, проявляющийся выраженными болями внизу живота в дни менструации с комплексом вегетативных, обменно-эндокринных, эмоционально-психических симптомов.
Известно, что из 35 млн. женщин детородного возраста 30-50% страдают от болей во время менструаций, при этом от 10 до 15% женщин каждый месяц в течение 1-3 дней нетрудоспособны (Межевитинова Е.А. с соавт., 2001).
Большинство авторов связывают проявления симптомов дисменореи с нарушением циклической секреции гонадотропных гормонов и высоким уровнем простагландинов в менструальном эндометрии, которые являются стимуляторами сократительной активности матки, приводя к спазму сосудов, локальной ишемии, раздражению нервных окончаний и возникновению боли (Прилепская В.Н. с соавт, 2001; Lundstrom V. et al., 1978).
Доказано, что КОК снижают выбросы простагландинов, в результате чего уменьшается сократительная маточная активность и боль – симптомы первичной дисменореи уменьшаются на 70-80%.
Кокрановский обзор сделал вывод о том, что КОК с дозами менее 35 мкг являются эффективными и должны быть препаратами выбора для лечения дисменореи (Wong C.L. et al., 2009).
Два рандомизированных исследования показали, что КОК эффективны для лечения как первичной дисменореи (Harada T. et al., 2011), так и для вторичной дисменореи, связанной с эндометриозом (Harada T. et al., 2008). Еще лучшие результаты могут быть получены путем использования КОК в непрерывном режиме. Головные боли, раздражение, усталость, вздутие живота и менструальные боли были значительно меньше при применении КОК в расширенных циклах (Edelman A.B. et al., 2005).
В обзоре Кокрейна (Wong C.L. et al., 2009) на основании 7 РКИ отмечается снижение дисменореи среди 497 женщин (ОР=2,01; 95% ДИ: 1,32-3,08). Для разных прогестагенов 3-го поколения не было никаких доказательств разницы в их эффективности (OР=1,11; 95% ДИ: 0,79-1,57). Для КОК 2-го поколения по сравнению с 3-го поколения разница составила 0,44 (95% ДИ: 0,23-0,84), что свидетельствует в пользу последних.
Оптимальные соотношения эстрогенного и гестагенного компонентов препарата НоваРинг благотворно влияют на матку, вызывая синхронизацию сокращений ее мышечных групп, уменьшая образование в ней простагландинов и тем самым, снимая боль. I. Lete Lasa (2006) провел оценку лечения дисменореи у 805 женщин, использовавших НоваРинг в течение 6 месяцев. Частота дисменореи значительно уменьшилась на фоне использования НоваРинга: с 55% – в начале исследования до 24% – к началу 4 цикла (р<0,001) и до 18% – после шестого месяца приема препарата (р <0,001 по сравнению с начальными показателями и р<0,001 по сравнению с показателями после 3 цикла) в группе женщин, которые не использовали гормональные контрацептивы до НоваРинга. В группе женщин, принимавших раннее другие гормональные контрацептивы, дисменорея также значительно уменьшилась: с 26% до 21% – после 3 цикла (р<0,005) и до 19% – после 6 (р<0,005).
Импланон – также один из наиболее эффективных гестагенных препаратов, который может применяться у женщин с дисменореей (Mansour D. et al., 2008).
В целом, согласно Руководству Американской коллегии акушеров и гинекологов по применению ГК по показаниям, не связанным с контрацепцией (ACOG, 2010), КОК уменьшают симптомы дисменореи практически у 80% женщин.
Данные о влиянии ЛНГ-ВМС на дисменорею ограниченны, однако, поскольку внутриматочная система приводит к уменьшению или исчезновению менструаций у многих женщин, по-видимому, эти эффекты соответствуют механизму действия.
Г. Предменструальный синдром
Предменструальный синдром (ПМС) – сложный патологический симптомокомплекс, возникающий за 2-10 дней до начала менструации и проявляющийся нервно-психическими, вегетативно-сосудистыми и обменно-эндокринными нарушениями. Симптомы ПМС исчезают в первые дни менструации или сразу после ее окончания (Barreiros F.A. et al., 2007).
Тяжелые и преимущественно психологические расстройства являются формой ПМС называемой «предменструальное дисфорическое расстройство (ПМДР). ПМС является результатом овуляции и, возможно, результатом повышенной чувствительности к прогестерону.
КОК предотвращает овуляции и должны быть эффективными для лечения ПМС. КОК обеспечивают подавление овуляции и уменьшают колебания секреции гонадотропинов и половых стероидов (Осипова А.А. с соавт., 2008). Тем не менее, данные из ограниченных исследований не поддерживают мнение об эффективности оральных контрацептивов, содержащих прогестагены, полученные из 19-нортестостерона (Freeman E.W. et al., 2001). КОК с низким содержанием дозы ЕЕ и новыми прогестагенами (дросперинон) улучшили их клиническую эффективность при ПМС (Dickerson V., 2002). Дроспиренон является производным спиронолактона с антиминералокортикоидной и анти-андрогенной активностью. Анти-андрогенная активность дроспиренона делает его также эффективным в сокращении акне и себореи. Антиминералокортикоидная активность помогает уменьшить некоторые из постоянных симптомов (таких как отек), связанных с предменструальной фазой менструального цикла.
В ряде исследований было показано положительное влияние КОК, содержащих ДРСП, на психологическое состояние (de Morais T.L. et al., 2014; Аганезова Н.В. et al., 2008; Apter D. et al., 2003; Bitzer J. et al., 2009; Gruber D.M. et al., 2006), улучшение настроения к 6-му циклу приема (Marr J. et al., 2011; Foidart J.M. et al., 2000), уменьшение симптомов депрессии, а также терапевтическое действие при предменструальном синдроме (ПМС) (Тихомиров А.Л., 2014; Ледина А.В., 2015; Басова О.Н. с соавт., 2011) и, даже, при предменструальном дисфорическом расстройстве (ПМДР) (Сасунова Р.А. с соавт., 2010; Rapkin A.J. 2008) и было связано с улучшением качества жизни (Fu Y. et al., 2014; Armstrong C., 2010).
В Кокрановском обзоре проанализировано пять исследований с участием 1920 женщин с ПМДР или тяжелой формой ПМС. Два исследования сравнивали 20ЕЕ/ДРСП и плацебо (Lopez L.M. et al., 2012). После трех месяцев применения было существенное снижение частоты и тяжести симптомов (-7,92; 95% ДИ: -11,16 – -4,67) у принимавших препарат.
Непрерывная оральная контрацепция обеспечивает большее подавление функциональной активности яичников и эндометрия и позволяет избежать циклического прерывания гормонального воздействия, которые могут вызвать некоторые симптомы, связанные с ПМС. Было показано, что этот способ оральной контрацепции связан с уменьшением симптоматики у пациентов (Edelman A.B. et al., 2005; Legro R.S. et al., 2008).
Применение современных комбинированных ГК позволяет снизить частоту и тяжесть симптомов ПМС в 2-3 раза и эффективно лечить его (Moore J. et al., 2003).
По результатам Межевитиновой Е.А. с соавт. (2001), эффективность лечения симптомов ПМС составляла от 33,3% до 90% и в среднем равна 55% при использовании КОК.
В проведенном I. Lete Lase исследовании, включавшем 805 женщин, отмечалось значительное уменьшение симптомов ПМС на фоне использования НоваРинга (рис. 9.4) с 55% в начале исследования до 24% к началу 4-го цикла и до 18% после 6 месяцев использования.
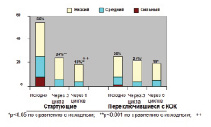
Рис. 9.4. Динамика симптомов ПМС на фоне использования НоваРинга (I. Lete Lase, 2006)
В одногодичном исследовании Milsom I. et al. (2006), изучавшем влияние НоваРинга на ПМС у 499 женщин, отмечено уменьшение количества женщин с ПМС с 34, 5% до 20,6% через 13 циклов использования вагинального кольца. При этом частота встречаемости ПМС средней и тяжелой степени тяжести уменьшилась с 12,6% до 4,5% и с 17,4% до 5,9% соответственно к концу исследования. Эти данные были сравнимы с результатами, полученными при использовании КОК, содержащего 30 мкг ЕЕ/ДРСП.
Д. Дисфункциональные маточные кровотечения
Как известно, дисфункциональные маточные кровотечения (ДМК) возникают у женщин в различные периоды их жизни и в зависимости от этого подразделяются на ювенильные, репродуктивного и климактерического возраста. При этом наиболее часто они возникают в период становления менструальной функции и в период ее угасания.
Считается, что 5% женщин в возрасте 30-49 лет имеют ДМК, 30% всех женщин имели ДМК в какой-то период времени в течении жизни.
В основе ДМК лежат нарушения циклической секреции гонадотропинов и ановуляция, приводящие к персистенции или атрофии фолликулов, относительной или абсолютной гиперэстрогении, снижению уровня прогестерона, развитию гиперпластических процессов в эндометрии и молочных железах. ГК подавляют пролиферативные процессы эндометрия, включая предраковые изменения, к которым принято относить очаговый аденоматоз, аденоматозные полипы, атипическую гиперплазию эндометрия.
Протективное (защитное) действие ГК связывают с торможением процесса овуляции, подавлением циклической продукции гонадотропинов, антипролиферативным действием и снижением митотической активности миометрия.
Целью лечения ДМК является остановка кровотечения и предотвращение рецидива. Если пациентка хочет забеременеть, то вторичной целью будет восстановление овуляции. Своевременный и правильный диагноз имеет решающее значение, так как ошибки в диагностике могут привести к неправильной медицинской тактике, ненужной операции, развитию гиперплазии эндометрия или рака.
ДМК является диагнозом «исключения», то есть прежде чем поставить этот диагноз, необходимо исключить дефицит гормонов, системные заболевания, гиперпролактинемию, органические заболевания матки, которые требуют соответствующего лечения. При их отсутствии и после хирургического или «гормонального» кюретажа требуется применение гормональных средств для профилактики рецидивов кровотечения, при этом препаратами выбора являются КОК (Farquhar C. et al., 2009).
В сравнительном плацебо-контролируемом исследовании было показано, что в целом у 68% женщин, принимающих КОК, был достигнут отличный или хороший результат нормализации цикла в отличие от 26% среди тех, кто получал плацебо (Davis A. et al., 2000).
Подходящей альтернативой являются также чистые гестагенные препараты. В литературе приводятся сведения об использовании вагинального микронизированного прогестерона и перорального дидрогестерона. Оба пути введения продемонстрировали улучшение регулярности цикла у 92% и 85% участников соответственно, достижении продолжительности цикла менее 35 дней и отсутствие межменструальных кровотечений в третьем цикле использования (Karakus S. et al., 2009).
НоваРинг обладает таким же механизмом действия на гипоталамо-гипофизарно-яичниковую систему и эндометрий, как и КОК, обеспечивает хороший контроль цикла (Dieben Т. et al., 2002; Novak A. et al., 2001), поэтому может быть использован для профилактики ДМК.
В исследовании Kloosterboer H.J. et al. (1988) было показано, что НоваРинг обеспечивает регулярность цикла лучше, чем КОК, содержащие 30 мкг ЕЕ/ДРСП – частота нерегулярных циклов к 13 месяцу использования НоваРинга и КОК составила 4,4 и 7,5% соответственно.
При этом менструации становятся менее обильными (частота их сократилась с 13,1% до 2,4% через 6 мес использования соответственно) за счет уменьшения толщины эндометрия.
Сrosignani Р. et al. (1997) провели сравнительное изучение результатов лечения ДМК у 70 женщин в возрасте 38–53 лет с помощью ЛНГ-ВМС (1-я группа) и резекции эндометрия (2-я группа). Через 1 год аменорея наблюдалась у 18% (1-я группа) и 26% (2-я группа), гипоменорея —
у 47 и 46%, меноррагия — у 12 и 8% соответственно.
Как считают Puolukka J. et al. (1996), лечение ДМК следует начинать с введения ЛНГ-ВМС. По их данным, 67% женщин избежали оперативного вмешательства в связи с хорошими результатами использования ЛНГ-ВМС.
Гиперплазия эндометрия
Гиперплазия эндометрия (ГЭ) составляет 4–20% в структуре общей гинекологической заболеваемости и встречается у 5% менструирующих женщин.
Основу диффузных эндометриальных гиперплазий составляют два процесса — избыточная пролиферация здорового эндометрия под влиянием относительной гиперэстрогении, вызванной ановуляцией, либо моноклональное разрастание генетически изменённой ткани (Чепик О.Ф., 2004).
Простая гиперплазия отражает в большей степени ановуляторную дисфункцию яичников. Именно поэтому при гиперплазии без атипии терапия направлена не столько на слизистую оболочку тела матки (особенно после выполнения кюретажа, когда патологический субстрат удален), сколько на восстановление гормонального баланса и предотвращение рецидива патологической пролиферации эндометрия. В пременопаузе гормональная терапия не может полностью избавить пациентку от вероятности рецидивов, связаны они будут с возрастной ановуляторной дисфункцией яичников. Поэтому хирургическая тактика в этот период не показана, а гормональное лечение следует планировать на максимально длительный срок.
Рекомендации RCOG и British Society for Gynaecological Endoscopy (BSGE) (2016) в качестве первой линии терапии рекомендуют в настоящее время использовать ЛНГ-ВМС, прогестины (норэтистерон, линестренол) или медроксипрогестерона ацетат.
В случаях, когда женщина планирует беременность, терапией выбора можно считать аналоги прогестерона.
У 40% женщин на фоне прогестиновой терапии эндометрий длительно сохраняет обратимую неактивную фазу, напоминающую атрофическое состояние (Томилова М.В., 2006). Аналогичным образом непрерывное использование прогестинов с успехом применяют для лечения и вторичной профилактики гиперплазии эндометрия.
Гиперандрогенная дермопатия
Основными источниками андрогенов в женском организме служат яичники и надпочечники. Однако андрогены также продуцируются в коже и жировой ткани, в связи с чем их уровни в крови не всегда коррелируют с клиническими проявлениями гиперандрогении. Под термином «гиперандрогения» зачастую понимают и лабораторные изменения, и клинические признаки избытка андрогенов, что отражено в Роттердамских критериях постановки диагноза синдрома поликистозных яичников.
Причинами гиперандрогении могут быть СПКЯ, врожденная дисфункция коры надпочечников (адреногенитальный синдром), андрогенпродуцирующие опухоли яичников или надпочечников, болезнь/синдром Иценко-Кушинга, гиперпролактинемия, акромегалия, гипоталамо-гипофизарный и/или метаболический синдром, нервная анорексия, шизофрения, врожденные нарушения половой дифференцировки (неполная форма тестикулярной феминизации, неполная маскулинизация, смешанная форма дисгенезии гонад). Повышение чувствительности рецепторов органов-мишеней (идиопатический гирсутизм) и транспортная форма (снижение уровня ГСПС) тоже требуют особого внимания клинициста на этапе диагностического поиска.
Гормональная активность андрогенов в клетках-мишенях опосредуется двумя типами белков: рецепторами андрогенов и ферментом 5α-редуктазой. Фермент 5α-редуктаза превращает тестостерон в дигидротестостерон — гормон, который непосредственно взаимодействует с рецепторами андрогенов в органах-мишенях. В результате действия избытка андрогенов у женщин появляются различной степени выраженности симптомы андрогензависимой дермопатии: вульгарные угри, себорея, гирсутизм, алопеция.
Вульгарные угри — это хроническое заболевание пилосебацейных фолликулов, находящихся под влиянием гормонов. Избыточное влияние андрогенов приводит к возникновению на коже папул, пустул, кист, открытых и закрытых комедонов. Различают 4 звена патогенеза угрей: гиперпродукция секрета сальных желез, фолликулярный гиперкератоз, возрастание патогенности Propionibacterium acnes и воспаление [30]. Вульгарные угри поражают до 80% молодых людей. Наиболее яркая клиническая картина угрей у женщин наблюдается в возрасте 17–18 лет. Около 50% женщин с гиперандрогенемией имеют вульгарные угри, которые локализуются на лице, шее, передней поверхности грудной клетки, спине. Андрогены приводят не только к повышению продукции кожного сала, но и к десквамации клеток фолликулярного эпителия, что является необходимым условием для формирования комедонов. В работе Falsetti L. et al. (2002) было показано, что возникновение вульгарных угрей связано с повышенными уровнями андростендиона, дегидроэпиандростерона и его сульфатной формы, но в отличие от гирсутизма очень мало коррелирует с уровнем дигидротестостерона в крови.
Себорея — усиление продукции кожного сала под влиянием андрогенов в характерных, так называемых себорейных, зонах (лицо, особенно носогубный треугольник и лоб, передняя поверхность грудной клетки, спина, плечи, волосистая часть головы), носит хронический рецидивирующий характер и сопровождается эритемой и шелушением кожи. Процесс обычно поражает несколько областей тела и встречается на лице у 88% пациентов, коже головы – 70%, груди – 27%, руках или ногах – 1-2% (Goldenberg G., 2013). Хотя причины себореи полностью еще не выяснены, предположительно она является результатом сочетания следующих трех факторов: повышенной секреции сальных желез, наличия Malassezia (дрожжи) и иммунного ответа хозяина (Sachdeva S., 2010).
Гирсутизм — это избыточный рост терминальных волос по мужскому типу у женщин, главным образом над верхней губой, на подбородке, боковых поверхностях лица, груди, животе, верхних и нижних конечностях. Рост волос на лобке также может быть по мужскому типу (Ferriman, Gallway, 1961).
Андрогензависимая алопеция — это прогрессирующее выпадение волос на голове по мужскому типу. Выпадение волос начинается с височных областей и далее распространяется на теменную и затылочную области, однако было показано, что среди женщин с повышенным уровнем андрогенов в крови только у трети имелась алопеция. Патогенез андрогенетической алопеции недостаточно изучен, однако на данный момент наиболее частой причиной ее считается повышение активности 5α-редуктазы.
Гиперандрогенная дермопатия является существенным косметическим дефектом, сопровождающимся раздражительностью, склонностью к депрессивным состояниям и другим психоэмоциональным расстройствам, снижающим качество жизни женщин.
Наличие гирсутизма и андрогенных дерматопатий далеко не всегда связано с ановуляцией и расстройствами функций эндокринных органов. Вне зависимости от уровня яичниковой и надпочечниковой секреции изменения метаболизма андрогенов могут привести к усилению их периферического действия.
Для купирования симптомов гиперандрогении у женщин, не планирующих беременность в ближайшее время, в качестве терапии первой линии ведущие гинекологические сообщества, такие как Androgen Excess and PCOS Society, European Society of Human Reproduction and Embryology, American Society for Reproductive Medicine, Endocrine Society, рекомендуют использование комбинированных гормональных средств, прежде всего – оральных (КОК).
В этом отношении клиницисту важно учесть четыре грани проблемы: потребность в контрацепции у женщин, уже имеющих андроген-ассоциированные изменения кожи и ее придатков; появление андроген-ассоциированных изменений кожи и ее придатков на фоне применения гормональных препаратов; контрацепция у женщин, получающих терапию ретиноидами; КОК как метод системного лечения акне и/или гирсутизма.
Приоритет выбора из всего многообразия КОК и их использования у женщин с андроген-ассоциированными изменениями кожи и ее придатков обусловлен фармакологическими возможностями комбинации эстрогена и гестагена. Любые КОК более эффективны, чем плацебо, поскольку они снижают сывороточные уровни андрогенов за счет следующих механизмов: супрессии выработки лютеинизирующего гормона (ЛГ), прямого подавления ЛГ-зависимой секреции андрогенов в яичниках; стимуляции выработки в печени ГСПС и повышения за счет этого связанных с белком фракций андрогенов, следствием чего будет уменьшение концентрации в крови свободных, биологически активных, андрогенов; небольшого снижения секреции надпочечниковых андрогенов; умеренного подавления связывания андрогенов с их рецепторами в тканях-мишенях за счет снижения активности 5α-редуктазы и продукции 5α-дигидротестостерона. Первые три механизма характерны для всех КОК. Однако последний присущ лишь антагонистам андрогеновых рецепторов и блокаторам 5α-редуктазы: ЦПА, ДРСП, ДНГ, хлормадинона ацетату (ХМА). Наряду с гестагенами III поколения (дезогестрел и гестоден) они демонстрируют более высокую эффективность по сравнению с КОК, содержащими гестагены I и II поколений, при этом «золотым стандартом» антиандрогенной терапии признан ЦПА. Вместе с тем сопоставимые с ЦПА клинические и биохимические эффекты демонстрирует ДНГ, ДРСП и ХМА.
Для лечения акне наряду с антиандрогенами традиционно применяются антибиотики и системные ретиноиды. При этом терапевтический вектор лечения антибиотиками направлен на борьбу с Propionibacterium acnes и воспалением, ретиноиды влияют на салообразование (что в полной мере присуще антиандрогенам), фолликулярный гиперкератоз и воспаление. Пациентки, получающие системные ретиноиды, нуждаются в самой надежной контрацепции, поскольку эти препараты абсолютно тератогенны и довольно гепатотоксичны.
В недавнем обзоре Cochrane представил комплексную оценку эффективности КОК для лечения акне у женщин (Arowojolu A.O.et al., 2012). Было установлено, что все виды КОК были эффективны для лечения акне, и что в этом отношении лишь незначительные различия существуют между КОК с различными типами гестагенов. Обе группы препаратов – КОК и негормональные антиандрогены – были успешно использованы при лечении акне. В течение 3-6 месяцев лечения КОК, воспалительные акне снижаются на 30-60%, с улучшением у 50-90% пациентов (van Wayjen R.G. et al.,1995).
Результаты лечения комбинацией 35ЕЕ/ЦПА в наиболее ранних исследованиях были хорошими или очень хорошими у 90% больных с акне [48]. В отношении акне тяжелой степени уменьшение общего количества поражений > 50% наблюдалась у 82,8% (95% ДИ 80,1-85,5) пациентов после шести циклов (Falsetti L. et al., 1986). Весьма эффективным в улучшении акне 35ЕЕ/ЦПА оказался, даже у женщин, которые были резистентны к другим видам лекарств (Falsetti L. et al., 1990). Прогрессирующее снижение общей андрогенной активности объясняет клинические результаты, которые были получены после 36 циклов лечения – акне исчезли в 100% случаев. Эти результаты подчеркивают необходимость длительного использования препарата в связи с этим были пересмотрены руководящие принципы в отношении ограничения применения 35ЕЕ/ЦПА только 3-4 мес и возможности длительного применения для достижения более стойкого результата (Franks S. et al., 2008; Cao H. et al., 2015).
Обзор исследований, изучавших нетрадиционные методы, включил 35 работ с 3227 участников и не обнаружил эффекта в лечении акне (масло чайного дерева, акупунктура, фитотерапия и другие методы) (Ibariez L, 2006).
Результаты лечения больных с гирсутизмом комбинацией 35ЕЕ/ЦПА в наиболее ранних исследованиях были хорошими или очень хорошими у 75% (Fugere P., et al., 1990). Значительное снижение гирсутизма по сравнению с исходным уровнем наблюдается через 9 месяцев при оценке по шкале Ферримана-Голлвея с 15,8±1,19 баллов до 8,4±1,21, или на 51% (van der Spuy Z.M. et al., 2003). Эффективность комбинации 35ЕЕ/ЦПА в отношении гирсутизма подтверждается в работе Badawy A. et al. (2011).
Прогестагены последнего поколения, также обладающие антиандрогенными свойствами – ДНГ и ДРСП, демонстрируют схожее клиническое действие, однако систематические обзоры указывают на более выраженный эффект КОК, содержащий ЦПА (Sahin Y. et al., 1998). Сравнительные исследования с другими антиандрогенами, например, с 5-альфа-редуктазой финастеридом и спиронолактоном, подтверждают их эффект в отношении гирсутизма, однако уступающий эффекту 35ЕЕ/ЦПА (Lobo R.A. et al., 1985; Spritzer P.M. et al., 2000; Moran L.J. et al., 2011). Отмечается также, что 35ЕЕ/ЦПА является экономически более эффективным препаратом. Совместное использование этих препаратов усиливает их действие, а инсулиновые сенситайзеры (противодиабетические препараты) и изменение образа жизни не имели никакой очевидной пользы с точки зрения тяжести гирсутизма. Как правило, требуется дополнительные косметические меры (эпиляция, обесцвечивание, электролиз, лазерная и фото-эпиляция), потому что необходимо, по крайней мере, от шести до 12 месяцев, чтобы достичь оптимального эффекта, кроме того, из-за дистресса, связанного с гирсутизмом, и его влияния на качество жизни, составляющей лечения должна стать психологическая поддержка (van Zuuren E.J. et al., 2015; Schindler A.E. et al., 1978).
Проявления себореи при использовании 35ЕЕ/ЦПА значительно уменьшаются у 76,4% пациентов при использовании на протяжении 36 циклов (Franks S. et al., 2008). В исследовании Schindler A.E. et al. отмечается, что клинические проявления себореи лучше других симптомов гиперандрогении (акне, гирсутизм) отвечают на терапию 35ЕЕ/ЦПА (улучшение достигнуто у 93,3% против 91,7% и 75,3% пациентов соответственно), включая полный или частичный терапевтический успех (Moltz L. et al., 1984). В случаях тяжелых клинических проявлений себореи добавление 10 мг ЦПА к 35ЕЕ/ЦПА в течение первых 15 дней цикла позволяет добиться эффекта у 81% пациентов уже к 6-му месяцу лечения и у 97% пациентов – к 12 месяцу (Shapiro J., 2007).
В отношении алопеции публикаций не достаточно, но КОК и блокаторы андрогенов обычно используются. В ограниченных исследованиях 35ЕЕ/ЦПА имел эффект, сопоставимый с финастеридом (Sinclair R. et al., 2005) и спиронолактоном (при отсутствии повышенных уровней андрогенов в крови) (Levy L.L. et al., 2013). В работе Алейниковой А.Л. (2005), посвященной этой теме, отмечается, что КОК, содержащие в своем составе ЦПА или ДНГ, оказывают сопоставимый антиандрогенный эффект, проявляющийся в коррекции гормональных нарушений и положительной динамике роста волос.
12-и месячный курс терапии КОК приводит к клиническому выздоровлению у 15,3% больных, к значительному улучшению – у 23,1%, к улучшению – у 43,1% и оказывается не эффективным у 18,5% больных, большинство из которых имеют периферический генез гиперандрогении.
Brzezinska-Wcislo L. (2003) в течение 6-9 мес. удалось снизить интенсивность выпадения волос, истончение и выраженность себореи. Однако по данным Lucky A.W. et al. (2004), несмотря на снижение выпадения волос, далеко не во всех случаях удается достичь стимуляции роста новых волос при монотерапии 35ЕЕ/ЦПА.
ДРСП является прогестагеном, который частично блокирует эндогенные андрогены из-за связывания с рецепторами андрогенов. Клиническая эффективность ДРСП-содержащего КОК в более тяжелых случаях при гиперандрогенных состояниях оказалась аналогична 35ЕЕ/ЦПА, что было показано в сравнительных исследованиях у женщин с клиническими проявлениями гиперандрогении (акне и себореей), а также с подтвержденным диагнозом синдрома поликистозных яичников (Соболева Е.Л., 2009; van Vloten W.A. et al., 2002).
Два плацебо-контролируемых РКИ одинакового дизайна были выполнены с использованием 20EE/ДРСП в течение 6 циклов (количество участников – 266 в группе, получавших КОК и 268 – в группе плацебо) и продемонстрировали следующие изменения. Снижение проявлений акне произошло у 49% женщин для воспалительных поражений (папулы, пустулы) (против плацебо – 33%); 40% – для невоспалительных поражений (открытые и закрытые комедоны) (против 22% в группе контроля). Полное или почти полное излечение было достигнуто у 18% пациенток (плацебо – 6%) (Maloney J.M. et al., 2008; Koltun W. et al., 2008). Эти 2 исследования обеспечивают высокий уровень доказательств эффективности 20EE/ДРСП в лечении, по крайней мере, умеренных проявлений акне лица в течение 6 циклов: ОШ=4,02 (95% ДИ: 2,29-7,31; р<0,0001), то есть эффективность была в 4 раза выше по сравнению с плацебо (Maloney J.M. et al., 2009; Lucky A.W. et al., 2008). Показано, что сочетание ДРСП с 30 и 20 мкг ЕЕ обладает сходным эффектом и к 5-му месяцу препараты способствуют статистически значимому уменьшению жирности кожи, а к 6-му – выраженности акне (2,2±0,6 и 2,5±0,8 баллов соответственно; р>0,05), а также гирсутизма (индекс Ферримана-Голлвея 2,8±0,5 и 3,0±0,6 баллов соответственно; р>0,05) (Артымук Н.В. с соавт., 2015).
Другим препаратом с антиандрогенным действием является КОК с ХМА. Высоким сродством ХМА к рецепторам прогестерона обеспечивается его значительная прогестагенная активность и выраженное воздействие на эндометрий (почти на 1/3 выше, чем у натурального прогестерона) (Handy R.W. et al., 1974). В отличие от натурального прогестерона выраженный прогестагенный и антиэстрогенный эффект ХМА сочетается с антиандрогенной активностью без антиминералокортикоидного действия (Neumann F. et al., 1978).
Антиандрогенные свойства ХМА реализуются путем конкурирования с андрогенами за связывание с рецепторами в клетках-мишенях, в том числе в тканях волосяных фолликулов и сальных желез кожи, что приводит к снижению выраженности себореи, aкнe, алопеции, гирсутизма и других проявлений вирилизации. Кроме этого, ХМА снижает синтез андростендиона и дигидроэпиандростерона сульфата в яичниках и надпочечниках, уменьшая тем самым уровень циркуляции в крови этих наиболее активных фракций андрогенов (Neumann F., 1994).
Важным биологическим эффектом ХМА является его блокирующий эффект на активность фермента 5a–редуктазы I типа, контролирующего чувствительность клеток тканей волосяных фолликулов и сальных желез кожи к влиянию эндогенных фракций андрогенов (Rabe T., 2000).
Сочетание ХМА с ЕЕ приводит к активации продукции печенью белков (глобулинов), связывающих половые стероиды, и повышению их уровня в плазме крови, что приводит к снижению абсолютного содержания циркулирующего свободного биологически активного тестостерона крови в 2–3 раза в течение 6 мес приема (Zahradnik H.P. et al., 2008; Kuhl H., 1995).
Эффективность ХМА с ЕЕ в отношении акне оценивалась в многочисленных сравнительных исследованиях, как с плацебо, так и с другими КОК. Так, снижение папуло-пустулезных акне наблюдалось в 64,1% (161/251) по сравнению с 43,7% (55/126) в группе плацебо (р = 0,0001) (Plewig G. et al., 2009).
Улучшение акне было более выраженным по сравнению с 30ЕЕ/ЛНГ – 95,6% против 81,1% соответственно (Spona J. et al., 2008). В сравнении с плацебо, общее разрешение симптомов себореи наблюдалось у 41,5% субъектов, принимающих от ЕЕ/ХМА и у 23,9% принимающих плацебо. У 17% женщин произошло существенное снижение выраженности гирсутизма в группе ЕЕ/ХМА в сравнении с 8,8% в группе плацебо.
При сравнении результатов лечения с помощью препаратов, содержащих ЕЕ/ХМА и ЕЕ/ЛНГ, оказалось, что в обеих группах наблюдалось снижение количества женщин с себореей после 12 лечения циклов – 80,0% по сравнению с 76,2% соответственно. Гирсутизм полностью исчез примерно у одной трети женщин в каждой группе лечения после 12 циклов лечения.
Даже, если эти данные можно считать только тенденцией из-за небольшой популяции пациентов, можно рассматривать ЕЕ/ХMA как препарат с хорошим профилем и в лечении гирсутизма (Worret I. et al., 2001).
По результатам исследования, проведенного I. Lete Lasa, у женщин, применявших в течение 6 месяцев НоваРинг, было отмечено уменьшение акне с 18,7% до 9,6% после 3-го цикла (р<0,001) и до 7,2% после 6-го цикла использования препарата у женщин, не применявших до исследования гормональные контрацептивы, и с 13,5% до 7,7% после 3-го цикла (р<0,001) и до 5% – после 6-го (р<0,001) у женщин, перешедших с КОК на НоваРинг.
Эндометриоз
Частота эндометриоза среди гинекологических больных репродуктивного возраста колеблется от 7 до 50%.
Первым этапом лечения больных внутренним эндометриозом матки следует считать гормональную терапию. Подавление секреции эстрадиола яичниками является основным принципом медикаментозной терапии эндометриоза. Агонисты гонадотропин-рилизинг-гормона (Золадекс, Бусерелин) и антигонадотропины (Данозол) считаются наиболее эффективными для лечения эндометриоза. Однако тяжелые метаболические побочные эффекты, плохая переносимость, высокая стоимость снижают их приемлемость у пациенток с симптоматическими формами эндометриоза.
Патогенетической основой гормональной терапии наружного генитального эндометриоза является временное угнетение циклической функции яичников, уменьшение секреции эстрадиола, что приводит к регрессу очагов эндометриоза.
Синтетические прогестины оказывают не только клинический эффект через гипоталамо-гипофизарно-яичниковую систему, тормозя в ней циклические процессы и подавляя гонадотропную активность, но и непосредственное действие на эндометриоидные гетеротопии, вызывая их регресс, гипотрофию и атрофию.
Циклический режим гормональной контрацепции является единственной формой лечения эндометриоза, при которой сохраняется ежемесячная менструальноподобная реакция. Дисменорея, при этом, является наиболее частой жалобой у таких пациенток. Переход к непрерывному режиму контрацепции может решить эту проблему.
Российский Протокол лечения эндометриоза (2013) содержит следующие рекомендации относительно гормональной терапии:
- КОК и монотерапию пероральными прогестагенами, применяемыми в непрерывном режиме, следует рассматривать в качестве первого этапа лечения при подозрении на наружный генитальный эндометриоз, отсутствии кистозных форм и аденомиозе (уровень доказательности Iа);
- аГнРГ или ЛНГ-ВМС – терапия второго этапа (уровень доказательности Iа);
- монотерапию аГнРГ можно проводить в течение не более 6 мес., для более длительного использования – только в комбинации с «возвратной» гормонотерапией (низкими дозами).
При этом КОК являются препаратами «первого выбора» для купирования связанной с эндометриозом тазовой боли у женщин, не имеющих противопоказаний и не планирующих беременность на данный момент времени (уровень доказательности Iа).
Непрерывный режим приема КОК имеет значительные преимущества при лечении эндометриоза по сравнению с циклическим режимом. Установлено, что перевод женщин с тяжелой формой дисменореи с циклического на непрерывный режим приема препаратов способствовал снижению интенсивности боли через 6 мес. на 58%, а через 2 года - на 75% (р<0,001).
Теоретическим обоснованием использования КОК при эндометриозе являются следующие положения (Strowitzki T. et al, 2010; Del Pup L., 2014):
- Эндометриоидная ткань самостоятельно синтезирует эстрадиол, в то время как 30EE/ДНГ поддерживает стабильно низкий уровень E2, который не может стимулировать рост очагов эндометриоза.
- Эндометриоидные ткани обладают устойчивостью к действию прогестерона, а ЕЕ регулирует рецепторы прогестерона, и тем самым повышает их чувствительность к ДНГ.
- КОК уменьшает риск рака яичников у больных эндометриозом значительнее, чем только ДНГ.
- Когда цель лечения эндометриоза состоит в уменьшении болевого синдрома, улучшении качества жизни, профилактики рака и получении эстроген-опосредованных благоприятных (неконтрацептивных) эффектов и контрацепции, то таблетки ЕЕ/ДНГ, являются лучшим выбором, чем только ДНГ.
- Кроме того, назначение КОК в послеоперационном периоде снижает вероятность рецидива симптомов заболевания и появление повторных эндометриом.
Медикаментозная терапия является важной альтернативой или дополнением к хирургии для симптоматического эндометриоза (RCOG, 2000). Прогестагены и КОК также эффективны, как более сложные и более дорогие препараты, такие как аналоги ГнРГ или ингибиторы ароматазы (Vercellini P. et al., 2011). КОК также снижают частоту послеоперационного рецидива эндометриоза и должны рассматриваться неотъемлемой частью долгосрочных терапевтических стратегий для того, чтобы ограничить дальнейший ущерб будущей рождаемости.
Прогестиновые контрацептивы способны эффективно подавлять активность гипоталамо-гипофизарно-яичниковой оси, тем самым угнетая циклические изменения в яичниках и секрецию эстрадиола, а непрерывный режим приёма не даёт возникнуть пику секреции эстрогенов, характерному для 7-дневного перерыва в использовании КОК. Это исключает нежелательные влияния на эндометриоидные гетеротопии: после хирургического удаления очагов эндометриоза и непродолжительного курса агонистов гонадотропин-рилизинг-гормона женщинам, не планирующим беременность, показаны именно прогестиновые контрацептивы.
Их назначение обеспечивает и профилактику рецидивов эндометриоза: дезогестрел эффективно подавляет пролиферацию как эндометрия, так и эндометриоидных гетеротопий (Доброхотова Ю.Э. с соавт., 2009).
Показано, что депо медроксипрогестерона ацетата и имплантат, высвобождающий прогестин, уменьшают болевой синдром, а ЛНГ-ВМС эффективно применяется для лечения дисменореи и хронической тазовой боли у женщин с эндометриозом.
Есть ряд исследований, подтверждающих положительное влияние применения Импланона у женщин при эндометриозе. В оригинальном исследовании Walch K. et al. (2009) сравнивали влияние Импланона на показатели болевого синдрома при эндометриозе в сравнении с Депо-Провера. Были продемонстрированы сопоставимые положительные данные. В статье Ponpuckdee J. et al. (2005) проведены результаты исследования 50 женщин с эндометриозом (подтвержденные лапароскопически). К 4 неделе выраженность симптомов по визуально-аналоговой шкале уменьшилась с 7,08±2,09 до 3,72±2.04 баллов, а к 12 неделе – до 0,84±1,67 баллов.
Сравнительное 2-летнее исследование гистологии эндометрия и цитологии шейки матки у пользователей имплантатов в Англии, продемонстрировало, что через 2 года применения Импланона значительно уменьшается толщина эндометрия, отсутствовали данные о повышенном риске развития гиперплазии эндометрия, рака эндометрия, CIN, или рака шейки матки. Не было отмечено изменений в цитологическом исследовании шейки матки.
В рандомизированном многоцентровом исследовании сравнивали пролонгированные режимы применения НоваРинга. Продленные режимы применения были эффективны, приемлемы, хорошо переносимы (Barreiros F.A. et al., 2007).
Лейомиома матки
В проведенном нами исследовании по изучению распространенности и потребности в консервативных методах лечения женщин с лейомиомой матки (Дикке Г.Б., 2010) было выявлено, что у большинства женщин лейомиома была небольших или средних размеров: без изменения общего объема – 46,9 % и объемом менее 200 см³ (до 8 недель) – 42,7 %, они не имели показаний для оперативного лечения, при этом большинство из них (73%) были в репродуктивном возрасте (30-49 лет). Пассивное наблюдение за больными лейомиомой матки на современном этапе развития медицины считается недопустимым.
Поэтому не вызывает сомнений, что эта группа пациенток нуждается как в эффективных методах контрацепции, так и в применении методов стабилизационной терапии для вторичной профилактики заболевания и торможения роста опухоли. Среди таких средств в периодической литературе в первую очередь упоминаются ГК и, хотя, не существует доказательных данных их лечебного действия на лейомиому, стабилизация содержания гормонов на базальном уровне без периодических колебаний способствует предупреждению развития заболевания, а также предотвращает меноррагии, которые являются наиболее частым симптомом этого заболевания.
По данным некоторых исследователей (Chiaffarino F. et al., 1999; Moroni R.M. et al., 2015) у пользователей КОК риск миомы матки ниже по сравнению с теми, кто ими никогда не пользовался ОР=0,3 (95% ДИ: 0.2-0-6); у экс-пользователей – сопоставим – ОР=1,1 (95% ДИ: 0,9-1,4); размеры миомы уменьшаются у пользователей в сравнении с теми, кто никогда не пользовался КОК – ОШ=0,8 (95% ДИ: 0,5-1,2) для 5 лет использования и ОШ=0,5 (95% ДИ: 0,349) для 7 лет или больше (р=0,03); КОК более эффективны по сравнению с плацебо в отношении влияния на размеры опухоли.
Стабилизация содержания гормонов на базальном уровне без периодических колебаний характерно для НоваРинга и способствует предупреждению прогрессирования развития лейомиомы матки, а также предотвращает меноррагии (рис. 9.3).

Рис. 9.5. Концентрация гормонов в крови при использовании НоваРинг по сравнению с КОК
Василенко Л.Н. и Новиковой Е.И. (2014) было продемонстрировано снижение риска рецидива лейомиомы матки после консервативной миомэктомии при применении препарата НоваРинг как у пациентов с изолированным заболеванием миомой матки, так и в сочетании с генитальным эндометриозом.
При сравнении двух основных групп обнаружено, что частота рецидива лейомиомы матки после операции в группе без последующей гормональной поддержки составила 22,3%, что достоверно выше (в 3 раза), чем частота рецидива опухоли во второй группе, где пациентки получали НоваРинг на протяжении 2-х лет – 6,9% (p<0,005). Относительно лечения лейомиомы матки данные не однозначные, как и для ЛНГ-ВМС, которые приведены в руководстве Американского конгресса акушеров-гинекологов по неконтрацептивному применению ГК (ACOG, 2010).
В литературе приводятся сведения о том, что использование Мирены приводит к снижению объема и длительности менструаций и в ряде случаев к олиго- и аменорее – именно этот эффект стал основанием применения ее у больных менометрорагией, ассоциированной с миомой матки и аденомиозом.
В результате серии исследований было достоверно показано, что введение Мирены приводит к нормализации менструальной функции, существенному снижению объема и длительности менструаций, в 20-25% случаев развивается аменорея, показатели гемоглобина приходят в норму (Coleman M. et al., 1997; Starczewski A. et al., 2000). На фоне применения Мирены не происходит увеличения размеров миоматозных узлов, то есть наблюдается их стабилизация. И в этом случае, чем меньше размер миоматозных узлов, тем более выражен стабилизирующий эффект рилизинг-системы.
Кроме того, введение Мирены является эффективным средством, обеспечивающим профилактику рецидивов роста миоматозных узлов и нормальный объем и длительность менструаций после проведения медикаментозного или органосохраняющего хирургического лечения (Тихомиров А.Л. с соавт., 2002). Айламазян Э.К. с соавт. (2004), Varma R. et al. (2006), продемонстрировали лечебный эффект ЛНГ-ВМС при гиперполименорее у женщин с миомой матки: показано существенное уменьшение менструальной кровопотери уже через 3 мес после начала применения метода, и у 40% пациенток отмечалась аменорея через год использования. По данным Острейковой Л.И. (2002), уменьшение миоматозных узлов с 1,49±0,3 см до 1,32±0,2 см отмечено у всех пациенток с миомой матки.
Метаболические нарушения при синдроме поликистозных яичников
Синдромом поликистозных яичников (СПКЯ) страдают от 6% до 10% женщин репродуктивного возраста (по некоторым оценкам – 15%), то есть заболевание является распространенным расстройством эндокринной системы.
Кузнецовой И.В. (2012) в обзоре литературы показано, что факторы риска для сердечно-сосудистых заболеваний, такие как гипертония, сахарный диабет, ожирение часто имеют место среди женщин с СПКЯ. Заболевание сопровождается гиперанрогенизмом, являющимся причиной гиперандрогенной дермопатии (акне, себорея, гирсутизм, алопеция), поэтому неконтрацептивные эффекты КОК с антиандрогенным действием широко используются у подростков и молодых женщин для улучшения симптомов и регуляции менструального цикла.
Инсулинорезистентность и ожирение вносят большой вклад в метаболические расстройства при СПКЯ, но исследования последних лет демонстрируют, что гиперандрогенемия – не менее важный независимый и (потенциально) модифицируемый фактор метаболического риска у этой категории больных. Значимость компонентов СПКЯ в формировании кардиометаболических расстройств позволяет отнести эту эндокринопатию в разряд заболеваний, обеспечивающих высокий риск сердечно-сосудистой патологии (Assessment of Cardiovascular …. 2010; Чазова И.Е. с соавт., 2004).
Существующие на сегодняшний день представления о патогенезе СПКЯ позволяют считать средством терапии первой линии КОК, действие которых направлено на главное патогенетическое звено заболевания – яичниковую гиперандрогению. Коррекцию гиперандрогении в составе КОК обеспечивают антиандрогенные прогестины: ципротерона ацетат, хлормадинона ацетат, диеногест и дроспиренон. Однако, улучшая гормональный профиль больной с СПКЯ, гормональные препараты далеко не всегда демонстрируют благоприятное действие на метаболический компонент заболевания (Кузнецова И.В., 2012).
Концепция профилактики кардиометаболического риска у больных с СПКЯ, таким образом, должна предусматривать, во-первых, коррекцию гиперандрогении, как ведущую причину ановуляции и накопления висцерального жира; во-вторых, предотвращение избыточной активности ренин-ангиотензин-альдостероновой системы; и в-третьих, раннее начало профилактических мероприятий, учитывающее прогрессивное развитие метаболических нарушений с течением времени.
Решение поставленной проблемы лежит в плоскости назначения КОК, прогестагенный компонент которого обладает не только антиандрогенной, но и клинически значимой антиминералокортикоидной активностью.
Единственный из прогестинов, отвечающий этим требованиям – ДРСП. Лечебные свойства ЕЕ/ДРСП у больных с СПКЯ в равной степени связаны с остаточной антиандрогенной и антиминералокортикоидной активностью и подтверждены клиническими исследованиями и врачебной практикой.
Мета-анализ исследований по проблеме влияния КОК на массу тела подытожил накопленные на сегодняшний день наблюдения и подтвердил преимущества ЕЕ/ДРСП перед препаратами, содержащими другие прогестины. Профилактические возможности ДРСП и содержащих его препаратов могут реализоваться в противодействии метаболическим эффектам гиперандрогении и органоповреждающим эффектам избытка альдостерона, значимым с позиций функционирования сердечно-сосудистой системы. Раннее использование ЕЕ/ДРСП в группах риска при необходимости предохранения от беременности может расцениваться как первичная профилактика сердечно-сосудистых заболеваний, хотя для подтверждения этого положения требуются долговременные исследования.
Перименопаузальные симптомы
Особенности гормонального гомеостаза в пременопаузе (гиполютеинизм, сменяющийся ановуляцией) предрасполагают к частому возникновению ДМК, 50% которых встречаются именно в этом возрастном промежутке. Это обусловливает актуальность регуляции менструального цикла и профилактики гиперпластических процессов эндометрия. Любые комбинированные ГК являются одним из методов лечения ДМК, при этом действие прогестинов на эндометрий эффективно предотвращает избыточную пролиферацию, а эстрогенов – вегетативно-сосудистые проявления (Прилепская В.Н., 2011).
Регуляции цикла (снижение объема кровопотери), профилактики гормонозависимых заболеваний можно добиться и при использовании и чисто гестагенных контрацептивов (Импланон, ЛНГ-ВМС), безопасность использования которых в пременопаузе выше, чем у КОК.
Кроме того, в перименопаузальном периоде женщины подвержены риску беременности, так как овуляция может иметь место до наступления менопаузы. Согласно рекомендациями ВОЗ, контрацепция рекомендуется женщинам вплоть до менопаузы и отсутствия менструации в течение 1 года в возрасте старше 50 лет, и в течение 2 лет для женщин моложе 50 лет.
Резюме
Гормональные контрацептивы, как комбинированные, так и гестагенные, обладают неконтрацептивными эффектами, которые можно с успехом использовать в целях лечения некоторых гинекологических заболеваний и их вторичной профилактики, обеспечив тем самым качество жизни женщин на долгие годы
