
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
7.4. Взаимосвязь типа кинетических кривых и химических реакций окисления
Как показано в главе 6, разные типы кинетических кривых окисления полимеров связаны с разными химическими реакциями, протекающими в процессе термоокислительной деструкции. В последние 20 лет выполнен большой объем работы по описанию реакций в неупорядоченных средах, к которым следует отнести и структуру аморфного состояния полимеров [33; 34], в рамках фрактального анализа [17; 35; 36]. Как указано выше, необходимость таких исследований вытекает из хорошо установленной в настоящее время фрактальной природы структуры полимеров на разных уровнях [37], а описание процессов, протекающих во фрактальных средах, корректно только в рамках фрактального анализа [38]. Поэтому авторы [39-41] выполнили анализ кривых с автоускорением и автозамедлением с использованием представлений фрактального анализа на примере двух ПААСО (ПААСО-1 и ПААСО-4, см. табл. 6.1).
Напомним, что в рамках фрактальных реакций в неупорядоченных средах диффузию реагента (молекулы оксиданта, радикала и т.д.) на фрактальной структуре полимера можно представить как блуждание этого реагента [24]. Существует два основных типа блужданий: случайное блуждание (СБ) и случайное блуждание с непрерывным временем (СБНВ) [36]. Если в случае СБ нет зависимости по времени между двумя последовательными блужданиями, то в случае СБНВ следующее блуждание может быть реализовано только через определенный промежуток времени после предыдущего. Таким образом, в случае СБНВ по существу вводится фрактальное множество времен событий [36]. В главе 6 модель СБНВ успешно использована для описания стабилизации ПААСО [42]. Для процесса термоокислительной деструкции сказанное выше означает, что акты химической реакции (разрыв цепи, образование радикалов, их аннигиляция или рекомбинация и т.д.) независимы друг от друга для СБ, но взаимосвязаны во времени для СБНВ [39].
На рис. 7.8 приведено сравнение экспериментальных и теоретически рассчитанных кривых для ПААСО-1 и ПААСО-4 при Тст = 573 К. Полученное на этом рисунке соответствие теории и эксперимента достигнуто при использовании следующих уравнений: для ПААСО-1 (режим автозамедления) [40]:
![]() , (7.21)
, (7.21)
и для ПААСО-4 (режим автоускорения) [40]:
![]() , (7.22)
, (7.22)
где спектральная размерность ds структуры ПААСО принята равной 1,48 (уравнение (4.29)).

Форма уравнений (7.21) и (7.22) позволяет определить тип реакции, реализуемой в процессе термоокислительной деструкции. Так, в режиме автозамедления имеет место бимолекулярная реакция (реакционноспособный центр макромолекулы + кислород), реализуемая с помощью СБ, а в режиме автоускорения - псевдомономолекулярная реакция (например, рекомбинация радикалов), реализуемая с помощью СБНВ [36].

На рис. 7.9 приведены зависимости Df от температуры теплового старения Тст для ПААСО-1 и ПААСО-4. Как можно видеть, для обоих сополимеров наблюдается монотонное снижение Df по мере роста Тст. На рис. 7.9 также указаны границы реализации трех основных кинетических режимов окисления ПААСО. Выше линии I или при Df ³ 2,78 наблюдается автоускоренный режим и ниже линии II или при Df £ 2,66 - автозамедленный режим. Кроме того, при Тст = 673 К в интервале Df = 2,43 ¸ 2,65 могут быть реализованы кинетические кривые S-образного (смешанного) типа [40]. Согласно соотношению (2.22), плотность макромолекулярного клубка r снижается по мере уменьшения Df. Следовательно, при больших Df (выше линии I на рис. 7.9) плотность макромолекулярного клубка велика, доступ оксиданта (кислорода) в его внутренние области ограничен и поэтому реализуется та реакция, которая требует меньшего количества кислорода, например, рекомбинация радикалов. При малых значениях r (ниже линии II на рис. 7.9, где величина r меньше 20 % от плотности соответствующего евклидова объекта) доступ кислорода существенно облегчен, что позволяет непосредственное протекание бимолекулярной реакции. Очевидно, в первом случае рекомбинация радикалов может произойти только через некоторое время после их образования и поэтому процесс моделируется с помощью СБНВ, а во втором случает акты диффузии молекул кислорода в полимер независимы друг от друга и процесс моделируется с помощью СБ.
![]() , (7.23)
, (7.23)
где gв - коэффициент.
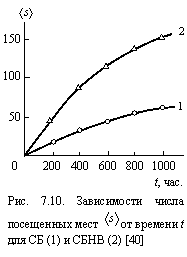
Из уравнений (7.21) и (7.22) следует, что для режима увтоскорения gв = 0,78, а для режима автозамедления - gв = 1,0. На рис. 7.10 приведены зависимости ![]() от времени t (в относительных единицах для СБ и СБНВ, т.е., величина
от времени t (в относительных единицах для СБ и СБНВ, т.е., величина ![]() рассчитана согласно соотношению (7.23) при gв = 1,0 и 0,78, соответственно. Как следует из графиков рис. 7.10, величина
рассчитана согласно соотношению (7.23) при gв = 1,0 и 0,78, соответственно. Как следует из графиков рис. 7.10, величина ![]() для СБНВ (режим автоускорения) существенно ниже, чем для СБ (режим автозамедления) [39].
для СБНВ (режим автоускорения) существенно ниже, чем для СБ (режим автозамедления) [39].
На рис. 7.11 приведены теоретические зависимости ![]() для режимов автоускорения и автозамедления (кривые 1 и 2, соответственно) для ПААСО-3 при Тст = 673 К, где экспериментальная кривая
для режимов автоускорения и автозамедления (кривые 1 и 2, соответственно) для ПААСО-3 при Тст = 673 К, где экспериментальная кривая ![]() имеет S-образную форму. Эти кривые построены согласно уравнениям (7.21) и (7.22), а постоянные коэффициенты в них получены методом наилучшего соответствия и по абсолютной величине они больше значений коэффициентов, полученных при Тст = 573 К (рис. 7.8), и равны 4,07 и 0,766, соответственно. На этом же рисунке точками показаны экспериментальные данные
имеет S-образную форму. Эти кривые построены согласно уравнениям (7.21) и (7.22), а постоянные коэффициенты в них получены методом наилучшего соответствия и по абсолютной величине они больше значений коэффициентов, полученных при Тст = 573 К (рис. 7.8), и равны 4,07 и 0,766, соответственно. На этом же рисунке точками показаны экспериментальные данные ![]() . Как можно видеть, при определенной величине t («выгорание» реакционноспособных групп, см. раздел 7.3) наблюдается переход от режима автоускорения к режиму автозамедления, что подтверждает промежуточный характер S-образной кинетической кривой. Авторы [39-41] предположили, что этот переход происходит при накоплении в макромолекулярных клубках количества кислорода, достаточного для протекания бимолекулярной реакции. Это полностью согласуется с критерием этого перехода rА < rB, рассмотренным в предыдущем разделе [27].
. Как можно видеть, при определенной величине t («выгорание» реакционноспособных групп, см. раздел 7.3) наблюдается переход от режима автоускорения к режиму автозамедления, что подтверждает промежуточный характер S-образной кинетической кривой. Авторы [39-41] предположили, что этот переход происходит при накоплении в макромолекулярных клубках количества кислорода, достаточного для протекания бимолекулярной реакции. Это полностью согласуется с критерием этого перехода rА < rB, рассмотренным в предыдущем разделе [27].

Авторы [43] предложили несколько отличающееся определение псевдомоно- и бимолекулярной реакций, которое соответствует классификации [13]. В этой трактовке псевдомономолекулярная реакция соответствует реакции распада макромолекулярного клубка в процессе термоокислительной деструкции как результат атаки клубка молекулой кислорода [13]:
A → B + C (7.24)
или
А → 2В, (7.25)
а бимолекулярная - реакции (4.34) или
2А → инертные продукты. (7.26)
Рассмотрим псевдомономолекулярную реакцию, в которой подвижный реагент, моделируемый случайным блужданием, реагирует с неподвижной «ловушкой» (реакционноспособным центром полимерной макромолекулы). Очевидно, в рассматриваемом случае подвижным реагентом является молекула кислорода, трактуемая как случайное блуждание [40]. В рамках фрактальной кинетики химических реакций такая реакция описывается уравнением [17]:
![]() , (7.27)
, (7.27)
где ![]() - предельное количество кислорода, способное поглотиться при окислении полимера; K - константа,
- предельное количество кислорода, способное поглотиться при окислении полимера; K - константа, ![]() - эффективная спектральная размерность.
- эффективная спектральная размерность.
Величина ![]() для ПААСО, как и ранее, принята как количество кислорода, требуемое для полного окисления метильных и алифатических групп полимера, и равное 24,1 моль О2/осн. моль полимера. Эффективная спектральная размерность
для ПААСО, как и ранее, принята как количество кислорода, требуемое для полного окисления метильных и алифатических групп полимера, и равное 24,1 моль О2/осн. моль полимера. Эффективная спектральная размерность ![]() может быть рассчитана согласно уравнению (1.72).
может быть рассчитана согласно уравнению (1.72).
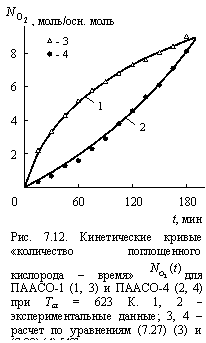
На рис. 7.12 приведено сравнение экспериментальных и рассчитанных согласно уравнению (7.27) (величина K получена методом наилучшего соответствия и равна 0,261) кинетических кривых ![]() для ПААСО-1 при Тст = 623 К. Как можно видеть, уравнение (7.27) хорошо описывает экспериментальные результаты и это означает, что кривым
для ПААСО-1 при Тст = 623 К. Как можно видеть, уравнение (7.27) хорошо описывает экспериментальные результаты и это означает, что кривым ![]() автозамедленного типа соответствует псевдомономолекулярная реакция вида (7.24) или (7.25), в которой роль ловушек играют реакционноспособные центры макромолекул ПААСО, а случайных блужданий - молекулы кислорода. Согласно рассмотренной выше классификации работы [36], эта реакция реализуется истинными случайными блужданиями (СБ), т.е., два последовательных акта диффузии молекул кислорода между собой никак не связаны.
автозамедленного типа соответствует псевдомономолекулярная реакция вида (7.24) или (7.25), в которой роль ловушек играют реакционноспособные центры макромолекул ПААСО, а случайных блужданий - молекулы кислорода. Согласно рассмотренной выше классификации работы [36], эта реакция реализуется истинными случайными блужданиями (СБ), т.е., два последовательных акта диффузии молекул кислорода между собой никак не связаны.

Бимолекулярная реакция в рамках фрактальной кинетики химических реакций описывается следующим уравнением [17]:
![]() , (7.28)
, (7.28)
где C6 - константа, определяемая методом наилучшего соответствия и равная для ПААСО-4 4,1 ´ 10-3 [43].
На рис. 7.12 приведено сравнение экспериментальных и рассчитанных согласно уравнению (7.28) кинетических кривых ![]() автоускоренного типа для ПААСО-4 (Df = 2,78, см. табл. 6.1) при Тст = 623 К. Вновь получено хорошее соответствие теории и эксперимента, а это означает, что для кинетических кривых
автоускоренного типа для ПААСО-4 (Df = 2,78, см. табл. 6.1) при Тст = 623 К. Вновь получено хорошее соответствие теории и эксперимента, а это означает, что для кинетических кривых ![]() автоускоренного типа реакция окисления представляет собой бимолекулярную реакцию, т.е., реакцию радикалов. Возвращаясь к рассмотренной выше классификации [36], отметим, что показатель у t в уравнении (7.28),
автоускоренного типа реакция окисления представляет собой бимолекулярную реакцию, т.е., реакцию радикалов. Возвращаясь к рассмотренной выше классификации [36], отметим, что показатель у t в уравнении (7.28), ![]() можно представить как 2
можно представить как 2 ![]() /2 = gв
/2 = gв ![]() /2. Такая форма указанного показателя предполагает [36], что происходит бимолекулярная реакция одинаковых радикалов (реакция рекомбинации), т.е., реакция типа (4.32) или (7.26).
/2. Такая форма указанного показателя предполагает [36], что происходит бимолекулярная реакция одинаковых радикалов (реакция рекомбинации), т.е., реакция типа (4.32) или (7.26).

На рис. 7.14 приведены теоретические кинетические кривые ![]() , рассчитанные согласно уравнению (7.28) при разных значениях
, рассчитанные согласно уравнению (7.28) при разных значениях ![]() . В отличие от данных рис. 7.13, в случае бимолекулярной реакции возможна реализация кинетических кривых как с автозамедлением (при
. В отличие от данных рис. 7.13, в случае бимолекулярной реакции возможна реализация кинетических кривых как с автозамедлением (при ![]() < 1), так и с автоускорением (при
< 1), так и с автоускорением (при ![]() > 1). Нетрудно видеть, что эта возможность обусловлена появлением множителя gв > 1 в показателе gв
> 1). Нетрудно видеть, что эта возможность обусловлена появлением множителя gв > 1 в показателе gв![]() /2 уравнения (7.28) или наличия временного беспорядка и в этом случае блуждания радикалов моделируются СБНВ. В случае СБ временной (энергетический) беспорядок отсутствует [36] и тогда кинетические кривые
/2 уравнения (7.28) или наличия временного беспорядка и в этом случае блуждания радикалов моделируются СБНВ. В случае СБ временной (энергетический) беспорядок отсутствует [36] и тогда кинетические кривые ![]() автоускоренного типа не реализуются вообще (рис. 7.13). Отметим, что условие перехода от автозамедленного режима окисления к автоускоренному
автоускоренного типа не реализуются вообще (рис. 7.13). Отметим, что условие перехода от автозамедленного режима окисления к автоускоренному ![]() = 1,0 (рис. 7.14) согласно уравнению (1.72) означает Df = 2,75, что хорошо согласуется с полученным в разделе 7.1 фрактальным критерием такого перехода, определяемым уравнением (7.6).
= 1,0 (рис. 7.14) согласно уравнению (1.72) означает Df = 2,75, что хорошо согласуется с полученным в разделе 7.1 фрактальным критерием такого перехода, определяемым уравнением (7.6).
Следовательно, изложенные выше результаты показывают, что каждому типу кинетических кривых ![]() в процессе термоокислительной деструкции соответствует определенный тип реакции. Для псевдомономолекулярной реакции всегда наблюдаются кинетические кривые автозамедленного типа, тогда как для бимолекулярной реакции возможны кривые и автозамедленного, и автоускоренного типов. Обязательным условием реализации кривых последнего типа является наличие временного (энергетического) беспорядка в системе [43].
в процессе термоокислительной деструкции соответствует определенный тип реакции. Для псевдомономолекулярной реакции всегда наблюдаются кинетические кривые автозамедленного типа, тогда как для бимолекулярной реакции возможны кривые и автозамедленного, и автоускоренного типов. Обязательным условием реализации кривых последнего типа является наличие временного (энергетического) беспорядка в системе [43].
