
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ЛЕЧЕНИЕ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩИХ РАН МЕТОДОМ ОЗОНОТЕРАПИИ И НИЗКОЧАСТОТНЫМ УЛЬТРАЗВУКОМ
Микитин И. Л., Карапетян Г. Э., Винник Ю. С., Якимов С. В., Кириченко А. К.,
1.2. Механизм действия и перспективы применения медицинского озона в клинической практике
В настоящее время все больше привлекают к себе внимание не медикаментозные методы лечения. Это связано с целым рядом факторов:
– большой частотой аллергических реакций на лекарственные препараты;
– большим количеством противопоказаний и побочных эффектов при назначении сильнодействующих лекарственных препаратов;
– увеличением количества сочетанных и сопутствующих заболеваний, что, с одной стороны, требует комплексного лечения, а с другой – увеличивает количество противопоказаний для назначения различных видов лечения;
– высокими ценами на лекарственные препараты.
К таким методам лечения относятся методы окислительной терапии: гипербарическая оксигенация, ультрафиолетовое облучение аутокрови, озонотерапия [32, 34, 175, 191].
В мировой лечебной практике применяются и используются способы локальной местной терапии, инфильтрация краев раны озонированными растворами, обработка ран и полостей организма озонированными растворами, ректальное введение газообразного озона, методика большой аутогемотерапии, малой аутогемотерапии, внутривенное, внутриартериальное и внутрисуставное введение озоно-кислородных смесей, озонирование аллокрови. Все авторы, работающие с этими методиками, подчеркивают, что озонотерапия – мощный и безопасный метод лечения, а результативность терапии неуклонно возрастает при лечении незапущенного первичного процесса [206, 218, 235].
Вместе с тем следует отметить, что за последние годы как в нашей стране, так и за рубежом создано новое поколение медицинских генераторов озона, позволяющих в течение длительного времени получать в стабильных концентрациях озон, как из медицинского кислорода, так и из атмосферного воздуха.
Благодаря выраженным окислительным свойствам, озон является высокотоксичным веществом. Окислительное действие озона может проявляться по-разному:
1) окисление, в котором играет роль лишь один атом кислорода из молекулы озона;
2) окисление с участием всех трех атомов кислорода;
3) окисление с образованием соединений исходного вещества с молекулой озона (озониды) [66, 76, 148].
Предельно допустимая концентрация его в воздухе составляет 100–200 мкг/м3. В высоких концентрациях озон чрезвычайно сильный окислитель, оказывает резко выраженное раздражающее действие на верхние дыхательные пути, бронхи, легкие, вызывая их спазм. При интоксикации озоном изменяется активность ряда ферментов эритроцитов, нарушается баланс биогенных аминов в организме, хромосомный аппарат лимфоцитов, метаболические процессы в печени, отмечается поражение сердечно-сосудистой и нервной систем, снижается устойчивость к инфекции, что связывают с подавлением продукции антител вследствие нарушения функции тимуса. Однако, концентрации озона, существующие в природных условиях, оказывают стимулирующее влияние на организм, повышая устойчивость к холоду, гипоксии, действию токсических веществ, увеличивая уровень гемоглобина и эритроцитов в крови, фагоцитарную активность лейкоцитов, иммунобиологическую устойчивость, улучшая функцию легких, нормализуя артериальное давление. Оценивая биохимические экспериментальные данные, выделяют следующие эффекты озонотерапии:
1. Повышение парциального давления кислорода и сдвиг рН в щелочную сторону.
2. Уменьшение дефицита буферных оснований, как более быструю реакцию на озонотерапию по сравнению с оксигенацией.
3. Активацию кислородзависимых процессов в эритроцитах и других клетках крови, в результате которых нормализуется перекисное окисление липидов (ПОЛ) и происходит регуляция структурно-функциональных элементов мембран клеток. При этом возрастает деформабельность эритроцитов, улучшаются реологические свойства крови [71, 147, 161].
4. Интенсификацию кислородзависимых реакций в органных клетках, вызывающую снижение уровня продуктов углеводного, липидного и белкового обменов [116, 194, 5, 1].
Обладая высокой реактогенной способностью, озон активно вступает в реакции с различными биологическими объектами, в том числе со структурой клетки. Плазматические мембраны являются основной мишенью озона в связи с плотной упаковкой липидов и белков в биомембранах. По мере нарастания дозы озона в плазматической
мембране (эритроциты, дрожжевые и бактериальные клетки) модифицируются силы межмолекулярного взаимодействия (изменения устойчивости к детергентам и направление криофрактографического скола), растет гидрофильность и бифазно (разнонаправлено) изменяется микровязкость анулярного и бислойного липида (зондовая флюоресценция), а также зарядовое состояние поверхности (данные электорофореза). Изменения физического и структурного состояния мембран связаны с окислительной деструкцией липидов и белков [64, 91, 147]. Происходит повышение резистентности эритроцитов и возрастание их деформабельности, что способствует оптимизации микроциркуляции. Вследствие подвижности двойного слоя мембраны дефекты в ней вновь закрываются. Это происходит до тех пор, пока дефекты значительно не увеличатся в размерах. Отсюда следует, что концентрация озона должна быть подобрана такая, чтобы оболочка клетки не изменялась, но сама была бы еще способна к восстановлению благодаря боковому смещению [2, 169, 193, 228].
Первоначально в крови с озоном реагируют ненасыщенные жирные кислоты и их сложные эфиры. Учитывая большое содержание этих соединений в организме, можно с большей долей достоверности предполагать, что большая часть введенного озона расходуется на реакции с С=С-связями с образованием биологически активных функциональных групп – озонидов. То, что озониды в большей степени определяют терапевтический эффект при парентеральном введении озона, подтверждается тем фактом, что синтезированные вне организма озониды сложных эфиров ненасыщенных жирных кислот, например, при озонировании растительных масел, также являются биологически активными соединениями: обладают противовоспалительными, антиаллергическими и иммуномодулирующими свойствами, улучшают микроциркуляцию и репаративные процессы в местах нанесения озонидов
[15, 111, 188]. Поскольку электрофильное присоединение к двойной связи С=С ненасыщенных жирных кислот представляет собой преимущественную реакцию озона, то эритроциты рассматриваются, как основные «мишени» в этой реакции при озонокислородной терапии. Это обусловлено тем, что оболочка эритроцитов содержит высокое процентное содержание фосфолипидов с ненасыщенными цепями жирных кислот, а они то и образуют центр реакции.
Объектами воздействия озона в организме, кроме ненасыщенных жирных кислот, являются еще вещества, которые содержат амино- и сульфгидрильные группы, в частности, аминокислоты, как свободные, так и с пептидными связями. В высоких концентрациях озон способен окислять белки, атакуя гистидиновые и тирозиновые остатки, деструктивно действовать на ДНК [44, 60, 149, 236].
Ряд авторов выделяют два механизма действия озона:
1) прямое действие озона, обнаруживаемое главным образом при локальном применении и проявляющееся в виде химиотерапевтической дезинфицирующей активности, вызывающей нарушение целостности оболочки микробов вследствие окисления фосфолипидов и липопротеидов; взаимодействие с вирусами, приводящее к повреждению протеинов наружной мембраны и полипептидных цепей нуклеиновых кислот, что нарушает способность вирусов прикрепляться к клеткам;
2) системный эффект вследствие индуцируемых озоном низких концентраций перекисей [107, 216].
Перекиси, образовавшиеся в результате взаимодействия озона с ненасыщенными жирными кислотами, активируют механизм перекисной дезинтоксикации – глутатионовую систему. Отмечено влияние озона на увеличение активности глутатионовой системы, формирующей внутриклеточную антиоксидантную защиту организма. Эффективность функционирования окислительно-восстановительной глутатионовой системы возможна при достаточном количестве НАДФ (никотинамиддинуклеотидфосфат), который необходим для восстановления окисленного глутатиона. Потребность в НАДФ в этих условиях, очевидно обеспечивается стимулированием озоном работы пентозофосфатного шунта.
Очень важное значение имеет влияние озона на перекисное окисление липидов. Под влиянием озона происходит умеренная активация перекисного окисления липидов с соответствующим усилением антиоксидантной системы [59].
Умеренная, «физиологическая» активация свободнорадикальных реакций ПОЛ и повреждающее действие усиленной генерации активных форм кислорода на клетки не означает, что эти процессы не протекают в норме. Наоборот, ПОЛ (в физиологических пределах) играет немаловажную роль и является даже одним из условий протекания некоторых метаболических процессов в нормальной клетке [212, 220].
Так, около 20 % всего количества 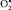 , образующегося в митохондриях, не успевает прореагировать с супероксиддисмутазой и, мигрируя через мембраны, поддерживает ПОЛ на стационарном, безопасном для клетки уровне. Если интенсификация этих процессов не выходит за определенные рамки, ограниченные антиоксидантными механизмами, то следует ожидать проявления физиологических эффектов умеренной активации свободнорадикальных реакций и реакций перекисного окисления липидов. Эти эффекты могут находить выражение в поддержании активности дыхательной цепи, биосинтеза некоторых гормонов, например стероидных и тиреоидных, простагландинов, лейкотриенов, тромбоксана А2, прогестерона, протромбина, стимуляции распада триптофана и так далее. Продукты ПОЛ в концентрациях, не превышающих 10 нмоль на 1 мг липидов, играют регуляторную роль в обеспечении процессов восстановления в нервной ткани после возбуждения. Активные формы кислорода и перекиси липидов могут играть роль «молекулярных фагов», способствуя деструкции микроорганизмов, фагоцитозу и очищению зоны повреждения. Супероксидный анион-радикал принимает участие в образовании хемотаксического фактора, вызывающего миграцию лейкоцитов в очаг воспаления. Активные формы кислорода играют роль кофакторов во многих биосинтетических процессах. Отклонение от стационарной концентрации
, образующегося в митохондриях, не успевает прореагировать с супероксиддисмутазой и, мигрируя через мембраны, поддерживает ПОЛ на стационарном, безопасном для клетки уровне. Если интенсификация этих процессов не выходит за определенные рамки, ограниченные антиоксидантными механизмами, то следует ожидать проявления физиологических эффектов умеренной активации свободнорадикальных реакций и реакций перекисного окисления липидов. Эти эффекты могут находить выражение в поддержании активности дыхательной цепи, биосинтеза некоторых гормонов, например стероидных и тиреоидных, простагландинов, лейкотриенов, тромбоксана А2, прогестерона, протромбина, стимуляции распада триптофана и так далее. Продукты ПОЛ в концентрациях, не превышающих 10 нмоль на 1 мг липидов, играют регуляторную роль в обеспечении процессов восстановления в нервной ткани после возбуждения. Активные формы кислорода и перекиси липидов могут играть роль «молекулярных фагов», способствуя деструкции микроорганизмов, фагоцитозу и очищению зоны повреждения. Супероксидный анион-радикал принимает участие в образовании хемотаксического фактора, вызывающего миграцию лейкоцитов в очаг воспаления. Активные формы кислорода играют роль кофакторов во многих биосинтетических процессах. Отклонение от стационарной концентрации 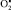 может вести к развитию патологических расстройств. Так, падение клеточного содержания
может вести к развитию патологических расстройств. Так, падение клеточного содержания 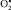 , связываемое с триосомией по 21-й паре хромосом, сопровождает некоторые психические расстройства. При шизофрении, например, из-за снижения содержания
, связываемое с триосомией по 21-й паре хромосом, сопровождает некоторые психические расстройства. При шизофрении, например, из-за снижения содержания 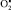 в клетках уменьшается активность дофамин-β-моноксигеназы, разрушающей дофамин. Дефицит
в клетках уменьшается активность дофамин-β-моноксигеназы, разрушающей дофамин. Дефицит 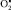 может вести к уменьшению интенсивности синтеза катехоламинов. Таким образом, повышение стационарной концентрации
может вести к уменьшению интенсивности синтеза катехоламинов. Таким образом, повышение стационарной концентрации 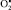 в тканях приводит к их окислительной деструкции, а снижение – к торможению некоторых биосинтетических процессов. Для некоторых мембранных ферментов перекиси липидов выступают в роли активаторов. Например, в малых дозах перекись линолевой кислоты увеличивает активность сукцинатдегидрогеназы и Са-АТФазы. ПОЛ в норме сопряжено с окислительным метаболизмом ксенобиотиков в системе микросомального окисления. Химическая модификация жирных кислот мембранных фосфолипидов является эффективным средством биохимической и функциональной модификации биомембран.
в тканях приводит к их окислительной деструкции, а снижение – к торможению некоторых биосинтетических процессов. Для некоторых мембранных ферментов перекиси липидов выступают в роли активаторов. Например, в малых дозах перекись линолевой кислоты увеличивает активность сукцинатдегидрогеназы и Са-АТФазы. ПОЛ в норме сопряжено с окислительным метаболизмом ксенобиотиков в системе микросомального окисления. Химическая модификация жирных кислот мембранных фосфолипидов является эффективным средством биохимической и функциональной модификации биомембран.
Таким образом, озон в результате умеренной активации свободнорадикальных реакций по принципу обратной связи усиливает собственную антиоксидантную систему [7, 3, 146, 156, 182].
Повышенная антиоксидантная активность крови, контролируя оптимальный уровень ПОЛ, поддерживает вазодилятационный эффект свободных радикалов. Наличие свободных радикалов кислорода, образованных при разложении озона в жидкой среде, стимулирует не только антиоксидантную систему крови, но и способствует улучшению микроциркуляции на тканевом уровне.
Обработка крови низкими концентрациями озона (18–48 мкг/л) вызывала развитие ответных реакций, проявляющихся в умеренной активации процесса перекисного окисления липидов и, по принципу обратной связи, усиления антиоксидантной защиты [1, 33, 237]. Описано также тормозящее действие озона на перекисное окисление липидов и стимулирующее действие на антиоксидантную систему. Внутрибрюшинное введение лабораторным животным озонированного изотонического раствора хлорида натрия (6–1 мг/л) угнетало процессы перекисного окисления липидов. Происходило снижение диеновых конъюгатов, малонового альдегида и оснований Шиффа в 3–5 раз. Одновременно повышалась активность каталазы и супероксидисмутазы эритроцитов крови [11, 144, 196, 233]. Увеличивалась микровязкость липидного бислоя мембран эритроцитов, снижалась их деформабельность и кислотная резистентность, что следует рассматривать как признаки неблагоприятных сдвигов в состоянии этих клеток. Повышалась антиоксидантная активность плазмы, что можно объяснить возрастанием в ней концентрации бета-липопротеидов, церулоплазмина, альбумина и инсулина. Под влиянием озонированного физиологического раствора хлорида натрия возможна компенсаторная мобилизация эндогенных антиоксидантов из депо и активация дополнительных звеньев антиоксидантной защиты.
Санирующее влияние озона связано с влиянием на бактерии, вирусы и грибки. Высокие дозы озона ингибируют Н-Атфазу и репродуктивную способность микробных клеток. Введение озонокислородной смеси (0,8 мг/л по 30 минут) в туберкулезную каверну подопытных животных приводило к гибели микобактерий туберкулеза и не оказывало токсического влияния на организм. Клетки, инфицированные вирусом СПИДа, при обработке озоном (10 мг/мл) утрачивали способность инициировать инфекцию при сокультивации их с незараженными клетками. При воздействии той же концентрации озона на внутриклеточный вирус, находящийся в ростовой среде с 15 % телячьей сывороткой, удалось на 33 % снизить ее активность. Следует учитывать, что антивирусное действие может быть обусловлено активацией иммунной системы. Под влиянием терапевтических доз озона возрастала пролиферация лимфоцитов [47, 204, 162].
Использование озона в высоких концентрациях возможно при местных аппликациях. Обработка инфицированных ран раствором, содержащим 4 мг/л озона, сопроврждалась подавлением роста стафилококков, кишечной и синегнойной палочек, протея и клебсиелл. При лечении гнойных ран выявлена четкая тенденция к увеличению количества функционально активных нейтрофильных лейкоцитов в ране в 2–3 раза по сравнению с контрольной группой. Лечебный эффект озонированных растворов инициируется как озоном, так и свободными радикалами [159, 167, 42, 19].
В основе терапевтического эффекта озонотерапии лежит окислительный «стресс» и адекватная мобилизация антиоксидантной системы, которые и определяют метаболическую и нейроэндокринную перестройку в организме, направленную на восстановление гомеостатического равновесия окислительно-восстановительных процессов [66].
Особенностью озонотерапии является то, что озон активно участвует в регуляции метаболизма кислорода, эффективно использует энергетические субстраты и стимулирует восстановление адаптационно-компенсаторных субклеточных структур.
С.П. Перетягин (1991) установил, что основными моментами лечебного действия озона являются:
– восстановление кислород – транспортной функции крови;
– выраженное влияние на метаболические процессы организма через озонолиз органических субстратов;
– умеренная инициация свободно-радикальных реакций ПОЛ с одновременным превалированием механизмов антиоксидант-
ной защиты;
– активация ферментных систем и восстановление энергетического потенциала клеток.
Это все служит базовой основой для улучшения микроциркуляции и периферического кровообращения.
Тропность озона к полиненасыщенным жирным кислотам, входящим в состав липопротеиновых и фосфолипидных комплексов цитоплазматических мембран микроорганизмов и вирусов, приводит к нарушению их целостности и гибели последних, что обусловливает его бактерецидный эффект.
В работах И.Л. Работнова и соавт. (1972) приводятся данные о чувствительности в водной среде к озону золотистого стафилококка, белого стафилококка, синегнойной и кишечной палочки. По их данным, гибель микроорганизмов находится в прямо пропорциональной зависимости от концентрации озона и времени экспозиции.
Установлено, что под воздействием озона устраняется энергетический дефицит тканей вследствие стабилизации ультраструктурных мембран и восстановления процессов окислительного фосфорилирования. Это позволяет клеткам стимулировать энергетический обмен и рекомбинировать синтез энергии в виде АТФ. При этом озон дает возможность стабилизировать многие гомеостатические реакции организма в результате коррекции ими окислительно-восстановительного потенциала клеток.
В крови образуются свободные радикалы и более стойкие озоновые перекиси, которые непосредственно влияют на метаболизм клеток, индуцируя процессы перекисного окисления липидов и тем самым стимулируя антиоксидантную систему организма.
Повышение продуктов перекисного окисления полиненасыщенных жирных кислот в крови, оказывающих инсулиноподобное действие, стимулирует транспорт глюкозы в клетку, прямое окисление ее в пентозофосфатном цикле, что улучшает обеспечение тканей кислородом и снижает уровень гипоксии.
Продукты пероксидации через активацию фосфолипазы А2 активизируют циклооксигеназный путь метаболизма арахидоной кислты в крови, снижая активность липооксигеназ. При этом угнетается синтез определенной группы простагландинов, клавулонов, лейкотриенов и др и активизируется индукция простациклина и тромбоксанов, которые, влияя на мембранную проницаемость, реологические свойства крови, уровень циклических нуклеотидов, микроциркуляцию, могут изменять состояние органного кровотока и повышать обеспечение организма кислородом, тем самым также снижая уровень гипоксии [190, 204].
Воздействие озона на цитоплазматические мембраны изменяет их структурно-функциональное состояние, вызывает компенсаторную перестройку нейрогуморальных регуляторных систем, что
интегрально проявляется стимуляцией энергетического обмена, процессов детоксикации, коррекции гормонального статуса, модуляцией системы иммуногенеза. Именно повышением активности нейтрофилов, Т-лимфоцитов и увеличением в крови иммуноглобулинов всех классов объясняют иммуномодулирующий эффект озона [240].
В начале развития воспалительного процесса метаболические и сосудистые нарушения приводят к возникновению и прогрессированию гипоксии, при которой анаэробный гликолиз преобладает над аэробным. Метаболические нарушения при гипоксии сопровождаются развитием выраженного ацидоза в области воспалительного очага. При этом происходит накопление недоокисленных продуктов, главным образом молочной и пировиноградной кислот. Отмечается снижение рН, которое характеризует степень гипоксии [89, 183].
Быстро реагируют на развитие воспаления дыхательные ферменты, необходимые для полноценной репарации. Их активность резко снижается, что может служить ранним признаком проявления некротических изменений в тканях. Все это создает благоприятный фон для развития инфекции.
Так, установлено, что в условиях ишемии для прогрессирования инфекции достаточно 10 бактерий, в то же время для того, чтобы вызвать нагноительный процесс в здоровых тканях необходима инъекция 2–8 миллионов микробных тел.
Одним из значительных терапевтических эффектов озонотерапии является антимикробное действие. При сравнительном изучении действия хлора и озона на микроорганизмы установлено, что инактивация их озоном происходит значительно быстрее. Практически важно, что озон подавляет микроорганизмы устойчивые к антимикробным препаратам. Его действие эффективно в отношении возбудителей дифтерии, туберкулеза, газовой гангрены, энтеробактерий, грибов. В результате окисления белков и липидов происходит деструкция цитоплазматических мембран микроорганизмов при воздействии на них озона. Минимальные дозы озона вызывают локальные повреждения мембран, прекращая процесс деления бактериальных клеток. Более высокие дозы вызывают повреждения ряда ферментативных, транспортных и рецепторных систем, обеспечивающих жизнедеятельность бактериальной клетки, что приводит к ее гибели в результате поражения дыхания и возрастания проницаемости цитоплазматической мембраны.
Концентрация озона 4 мг/л, полностью подавляет рост стафилококка, кишечной палочки, протеев и клебсиеллы, если их количество соответствует 103–104/г ткани. При количествах микроорганизмов более 105/г ткани инактивация микроорганизмов неполная [67, 12, 115, 231, 235].
При однократном местном воздействии озона-кислородной воздушной смесью количество стрептококков и синегнойной палочки уменьшается в три раза, энтеробактерий – более чем в два раза. Общее количество микроорганизмов снижается на 41,3 %, количество стерильных посевов увеличивается в 6 раз. Исходная микрофлора уничтожается в течение 1–2 сеансов озонирования [183, 115].
Различные виды микроорганизмов обладают неодинаковой чувствительностью к озону. Это может быть связано со строением бактериальной стенки и активностью защитных ферментов – супероксиддисмутазы, каталазы. Катализируемые ими реакции десмутации переводят супероксидный радикал в менее токсичное для клетки состояние. Особенно выражен этот эффект у грамотрицательных бактерий [107, 147].
При изучении действия озона на дрожжевые клетки различных групп. Оказалось, что при умеренных концентрациях клеток кривые их гибели имели первичный переход быстрой инактивации, сменяющийся периодом медленной инактивации. При больших концентрациях клеток после периода медленной инактивации происходило ее вторичное ускорение. Отмечено, что гибель микроорганизмов происходит в результате окислительной деструкции и нарушения барьерной функции мембран. Озон интенсивно взаимодействует с органическими соединениями, содержащимися во внеклеточной среде, выступая в роли химического барьера защиты клеток. По-видимому, снижение скорости инактивации происходит за счет выхода из погибших клеток внутриклеточных метаболитов [32].
Вторичное же ускорение гибели клеток обусловлено накоплением токсических продуктов озонолиза и их литическим действием на клетки.
Действие озона на микробные клетки имеет бифазный характер. У дрожжевых клеток низкие дозы озона стимулировали Н-АТФ фазу, дыхание и репродуктивную способность. Высокие дозы озона ингибировали этот процесс и приводили к гибели клеток [88, 147].
Антимикробное действие озона при различных способах его применения изучалось практически всеми исследователями, которые занимались вопросами озонирования. Однако, имеющиеся в литературе сведения преимущественно касаются бактерицидного действия озона в отношении аэробных и факультативных анаэробных микроорганизмов. Но, имеются сведения и о бактерицидном действии озона в отношении облигатных неспорообразующих анаэробных бактерий, чувствительность микробов к антибиотикам возрастает. Описано также фунгицидное и противовирусное действия. Причем выраженность антимикробного эффекта зависит от применяемых концентраций медицинского озона, времени экспозиции и количества сеансов обработки.
В клинической практике при комплексном лечении гнойных ран, трофических язв, ожоговых поверхностей, огнестрельных ранений, в особенности при длительном вялом течении воспалительного процесса, применение медицинского озона (как местное, так и общее) сопровождается активизацией процессов очищения раны и регенерации, улучшением общего состояния больных, быстрой ликвидацией симптомов интоксикации, что выражается в сокращении сроков госпитализации и реабилитации больных и уменьшении количества осложнений.
Очищение раневой поверхности и активизация регенераторных процессов, сокращение во времени стадий раневого процесса, являются логическим следствием антимикробного и иммуностимулирующего (местного и общего) действия озона.
Сокращение сроков очищения раны в первой фазе раневого процесса – фазе экссудации, происходит благодаря дегидратирующему и некролитическому действию озона [42, 204].
Некролитический эффект обусловлен разрушающим воздействием на белковые молекулы, аминокислоты, полисахариды, так как озон взаимодействует с продуктами распада белков и аминокислот. Усиление дегидратации способствует ускоренному отведению продуктов распада из раны, что снижает их непосредственное раздражающее действие на клетки местной защиты и способствует повышению функциональной активности фагоцитов.
Местный обезболивающий эффект при озонировании раневой поверхности обусловлен, во-первых, уменьшением раздражающего действия бактерий и токсических продуктов на нервные окончания стенки раны и, во-вторых, тормозящим влиянием на периферические нервные окончания после кратковременного раздражающего действия [148].
Отмечается также гемостатический эффект при наружной обработке раны озон-кислородной газовой смесью или озонированными растворами антисептиков, либо физиологическими растворами на фоне проводимой общей озонотерапии. При этом продолжительность кровотечения, в среднем, сокращается вдвое за счет увеличения концентрации фибриногена и количества тромбоцитов.
С учетом указанных выше механизмов, ведущих к гипоксии в гнойной ране, патогенетически обосновано применение кислорода, выделяемого из озона. Терапевтические эффекты озона обусловлены, прежде всего, его окислительными свойствами. Антигипоксический эффект сопровождается повышением кислород-транспортной функции крови, улучшением ее реологических свойств и активацией биоэнергетических процессов за счет увеличения концентрации кислорода в плазме. При этом снижается кислородное голодание тканей, возрастает метаболическая активность форменных элементов крови и тканевых клеток [4, 107, 198]. Это сопровождается ростом активности ферментов дыхательной цепи и окислительного фосфорилирования, что ведет к восстановлению энергообразования.
Озонированные масла и родственные продукты зарекомендовали себя, как хорошее средство при лечении широкого круга заболеваний, в первую очередь слизистой оболочки и кожных покровов. Однако их успешное использование затруднено из-за недостаточной стабильности озонидов.
Было изучено поведение озонированных подсолнечного масла, линетола и гексена-1 в случае длительного хранения при 2 и 20 °С. Стабильность образцов возрастала в ряду гексен-1, линетол, подсолнечное масло. Период полураспада составил при 20 °С – 3 мес., при 2 °С – 8 мес. Разработан метод озонирования растительных масел, который позволил получить препарат с высоким перок-
сидным числом.
В масле «Отри 6000» удалось затормозить течение побочных реакций и практически полностью исключить образование побочных соединений, таких, как малондиальдегид, гидроперекись и др. Механизм лечебного действия масла «Отри 6000» связан с его анальгетическим, противовоспалительным и антиаллергическим действием. Оно обладает противовирусными и фунгицидными свойствами, стимулирует репаративные процессы и местный иммунитет, способствует быстрому очищению язвы от некротических масс, улучшает микроциркуляцию. Это обусловлено тем, что особо чувствительны к озону органические соединения, содержащие двойные связи, которые имеют различные липидные компоненты тканей. После озонотерапии отмечается снижение количества фосфолипидов, триглециридов, свободных жирных кислот. Таким образом, в тканях увеличивается содержание тех жирных кислот, которые наиболее активно используются в качестве энергетического субстрата, повышается метаболическая активность полиморфноядерных нейтрофилов, увеличивается их антимикробная активность. При хранении масла в течение 1 года при температуре 5 °С активность его снижается не более чем на 15 %.