
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ЛЕЧЕНИЕ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩИХ РАН МЕТОДОМ ОЗОНОТЕРАПИИ И НИЗКОЧАСТОТНЫМ УЛЬТРАЗВУКОМ
Микитин И. Л., Карапетян Г. Э., Винник Ю. С., Якимов С. В., Кириченко А. К.,
3.1. Морфологическое исследование процесса заживления трофических язв венозной этиологии
Клинический этап исследований был выполнен на базе 1-го хирургического отделения НУЗ «Дорожная клиническая больница на станции Красноярск», а также 1-го и 2-го хирургических отделений МГУЗ «Городская клиническая больница№ 7» г. Красноярска в период с 2006 по 2015 г.
Всего под нашим наблюдением находилось 137 больных с трофическими язвами венозной этиологии. Большинство из них – 60 % составляли женщины и 40 % – мужчины. По социальному составу в основном это были пенсионеры, инвалиды. На стационарное лечение больные поступали в плановом порядке. Всех больных разделили на 4 группы, сопоставимые по возрасту, полу и тяжести течения заболевания.
В первой группе, состоящей из 35 больных, проводилось традиционное лечение. Для антибактериальной терапии по показаниям применяли цефазолин. Локальная обработка раны проводилась 0,5 % раствором хлоргексидина и актовегином. Во второй группе больных для обработки раны применяли озонированную дистиллированную воду с концентрацией озона 5 мг/л. При переходе раневого процесса во II фазу лечение проводилось озонированным оливковым маслом «Отри». В третьей группе, состоящей из 31 пациента, пораженные участки ежедневно обрабатывались ультразвуком. Для среды проведения волн применяли в первую фазу раневого процесса раствор хлоргексидина, во вторую фазу актовегин.
В четвертой группе также проводилась ежедневная ультразвуковая обработка пораженного участка. Для среды проведения волн применяли в первой фазе раневого процесса озонированный раствор, во второй фазе озонированное оливковое масло «Отри».
Исследование биоптатов краев длительно незаживающей раны у пациентов всех четырех групп, взятых при некрэктомии перед началом лечения, показало, что морфологическая картина воспалительно-некротических изменений была схожа.
В коже определялся дефект эпидермиса. В сохранившихся участках эпидермис был с выраженными диспластическими изменениями. В зоне дефекта эпидермиса поверхность дермы была покрыта струпом. Наблюдался выраженный отек дермы, утолщение пучков коллагеновых волокон, фиброзирование подкожной жировой клетчатки, инфильтрация большим количеством сегментоядерных нейтрофилов, макрофагами, лимфоцитами.
Сосуды были расширены, полнокровны. Определялся отек и признаки фибриноидного набухания стенок мелких сосудов, в капиллярах эндотелий был отечен, пролиферировал.
Фибробласты дермы были крупными, с большими светлыми ядрами, которые группировались вокруг сосудов (рис. 3.1–3.4).
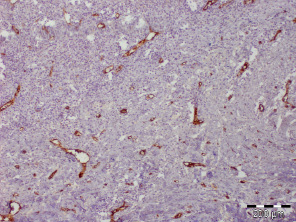
Рис. 3.1. Биоптат из дна раны пациента 1-й группы перед лечением. Экспрессия CD31 эндотелием сосудов. Ув. х100
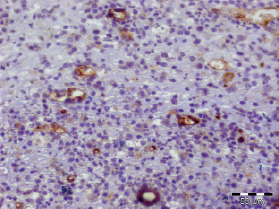
Рис. 3.2. Биоптат из дна раны пациента 2-й группы перед лечением. Экспрессия CD31 эндотелием сосудов. Ув. х400
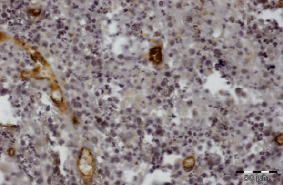
Рис. 3.3. Биоптат из дна раны пациента 3-й группы перед лечением. Экспрессия CD31 эндотелием сосудов. Ув. х400
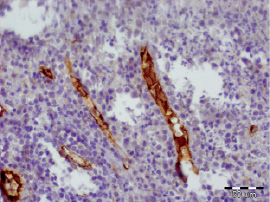
Рис. 3.4. Биоптат из дна раны пациента 4-й группы перед лечением. Экспрессия CD31 эндотелием сосудов. Ув. х400
В клеточном инфильтрате во всех группах отмечалось статистически значимое преобладание нейтрофильных гранулоцитов, и сравнительно небольшое содержание макрофагов, лимфоцитов и фибробластов (табл. 3.1). Статистически значимых различий по этим показателям у пациентов различных групп не было.
Количество сосудов на единицу площади дермы также не имело статистически значимых отличий между пациентами разных групп (табл. 3.1).
При гистологическом и морфометрическом исследовании биоптатов из краев длительно незаживающих ран через 10 суток после начала лечения у пациентов патогистологическая картина течения раневого процесса была различной.
У больных 1-й группы в биоптате кожи определялся менее выраженный отек по сравнению с предыдущим сроком. Полиморфно-клеточная воспалительная инфильтрация сохранялась на прежнем высоком уровне, но отмечалось уменьшение доли нейтрофильных гранулоцитов с увеличением количества макрофагов, лимфоцитов и фибробластов (табл. 3.2). Наблюдалось увеличение числа капилляров на единицу площади дермы (табл. 3.2).
Таблица 3.1
Содержание клеточных элементов (в %) и кровеносных сосудов (количество на 1 кв. мм) в соединительной ткани вокруг раны перед началом лечения (M ± σ)
|
1 группа |
2 группа |
3 группа |
4 группа |
|
|
Нейтрофилы |
55,61 ± 3,27 |
56,00 ± 2,47 |
55,71 ± 3,05 |
56,00 ± 3,04 |
|
Лимфоциты |
9,85 ± 1,33 |
9,98 ± 1,24 |
9,70 ± 1,32 |
10,00 ± 1,22 |
|
Макрофаги |
9,39 ± 1,05 |
9,22 ± 1,20 |
9,30 ± 1,30 |
9,07 ± 1,13 |
|
Фибробласты |
25,15 ± 2,49 |
24,8 ± 1,87 |
25,29 ± 2,36 |
24,93 ± 2,62 |
|
Кровеносные сосуды |
60,65 ± 17,7 |
Примечание. Нет статистически значимых отличий (р > 0,05).
Таблица 3.2
Содержание клеточных элементов (в%) и кровеносных сосудов (количество на 1 кв. мм) в соединительной ткани вокруг раны
на 10 день лечения (M ± σ)
|
1 группа |
2 группа |
3 группа |
4 группа |
|
|
Нейтрофилы |
45,04 ± 2,71 |
35,89 ± 2,70* |
35,30 ± 3,25* |
29,98 ± 3,02 |
|
Лимфоциты |
10,98 ± 1,35 |
11,09 ± 1,29* |
11,18 ± 1,25* |
8,98 ± 1,20 |
|
Макрофаги |
12,96 ± 1,83 |
15,93 ± 1,92* |
16,63 ± 1,87* |
21,03 ± 1,94 |
|
Фибробласты |
31,03 ± 2,92 |
37,09 ± 3,49* |
36,89 ± 3,53* |
40,00 ± 2,93 |
|
Кровеносные сосуды |
Примечание. * – нет статистически значимых отличий показателей по этим параметрам между этими группами (р > 0,05). Показатели остальных групп статистически значимо отличаются друг от друга (р < 0,05).
У пациентов 2-й группы, которым обрабатывали рану озонированной дистиллированной водой и озонированным маслом, также наблюдалось снижение морфологических проявлений воспаления, сопровождающееся уменьшением отека, ростом капилляров, менее выраженной, по сравнению с контрольной группой, инфильтрацией нейтрофилами, макрофагами и лимфоцитами. При сравнении соотношения клеточных элементов в дерме, отмечалось снижение числа нейтрофилов, за счет увеличения количества макрофагов и фибробластов (табл. 3.2). Также увеличивалось количество сосудов на единицу площади дермы, по сравнению с контрольной группой (табл. 3.2).
У пациентов 3-й группы в микропрепаратах из края раневого дефекта по сравнению с предыдущим сроком наблюдения определялось уменьшение отека дермы, степени метахромазии коллагеновых волокон, уменьшение плотности воспалительного полиморфно-клеточного инфильтрата. В клеточном инфильтрате статистически значимо уменьшалось количество нейтрофилов, увеличивалось количество макрофагов. Отмечалось также увеличение доли фибробластов и количества новообразованных сосудов на единицу площади (табл. 3.2).
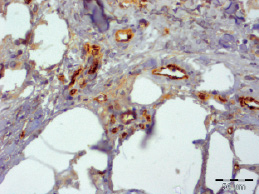
Рис. 3.5. Биоптат из края раны пациента 1-й группы на 10 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х400
У пациентов 4-й группы на 10 день после начала лечения в гистологических препаратах наблюдалось снижение степени отека межклеточного вещества, уменьшение инфильтрации нейтрофилами, лимфоцитами, макрофагами, увеличение количества новообразованных капилляров.
Струп был тонкий, представлен фибринозными массами с примесью нейтрофилов (рис. 3.5–3.8). При этом так же, как и в других группах, отмечалось уменьшение доли нейтрофилов и увеличение доли макрофагов, фибробластов и лимфоцитов (табл. 3.2).
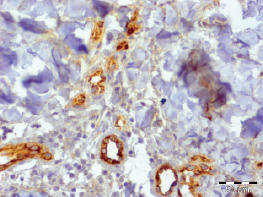
Рис. 3.6. Биоптат из края раны пациента 2-й группы на 10 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х400
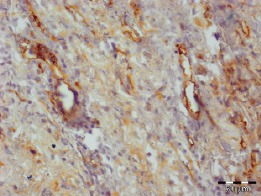
Рис. 3.7. Биоптат из края раны пациента 3-й группы на 10 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х400
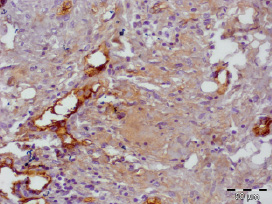
Рис. 3.8. Биоптат из края раны пациента 4-й группы на 10 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х400
При сравнении соотношения клеток и количества капилляров в дерме в зоне воспаления между пациентами разных групп на 10 сутки лечения статистически значимо уменьшалась доля нейтрофилов во 2-й, 3-й и 4-й группах по сравнению с 1-й (контрольной) группой. При этом статистически значимых различий между 2-й и 3-й группами не было. Уменьшение доли нейтрофильных гранулоцитов происходило за счет увеличения количества макрофагов и фибробластов у пациентов опытных групп по сравнению с пациентами контрольной группы. Между пациентами 2-й и 3-й опытных групп статистически значимых отличий по этому показателю не было.
У пациентов 4-й группы уменьшалось количество нейтрофилов и увеличивалось количество макрофагов и фибробластов данные изменения были статистически значимыми по сравнению со всеми группами (табл. 3.2).
При гистологическом и морфометрическом исследовании биоптатов из раны через 20 дней лечения различными способами во всех группах отмечалось прогрессивное уменьшение морфологических признаков воспаления: уменьшался отек, образовывались кровеносные
сосуды, уменьшалась клеточная воспалительная инфильтрации, появлялись признаки регенерации эпидермиса.
У пациентов контрольной группы на 20 сутки лечения в ране определялось разрастание вновь образованных капилляров. Эти сосуды располагались в скоплениях фибробластов, макрофагов, лимфоцитов. Сохранялась диффузно-очаговая инфильтрация нейтрофилами, в поверхностных слоях дермы под струпом.
Эпидермис с регенераторно-диспластическими изменениями определялся в краевой зоне. Также как и в предыдущие сроки, отмечалось уменьшение количества нейтрофилов за счет увеличения числа макрофагов, фибробластов и лимфоцитов. Наблюдалось увеличение количества сосудов (табл. 3.3).
Таблица 3.3
Содержание клеточных элементов (в %) и кровеносных сосудов (количество на 1 кв. мм) в соединительной ткани вокруг раны
на 20 день лечения (M ± σ)
|
1 группа |
2 группа |
3 группа |
4 группа |
|
|
Нейтрофилы |
35,45 ± 2,98 |
26,85 ± 2,83* |
27,71 ± 2,78* |
19,30 ± 1,97 |
|
Лимфоциты |
7,91 ± 1,02 |
7,65 ± 1,24 |
6,93 ± 1,16 |
6,13 ± 1,40 |
|
Макрофаги |
17,48 ± 1,59 |
20,48 ± 2,18* |
20,93 ± 1,73* |
8,08 ± 1,15 |
|
Фибробласты |
39,16 ± 2,64 |
45,02 ± 3,55* |
44,43 ± 2,66* |
66,48 ± 2,9 |
|
Кровеносные сосуды |
90,56 ± 20,54 |
147,94 ± 20,49 |
Примечание.* – нет статистически значимых отличий показателей по этим параметрам между этими группами (р > 0,05). Показатели остальных групп статистически значимо отличаются друг от друга (р < 0,05).
У пациентов 2-й группы развивалась зрелая грануляционная ткань под тонким струпом, который замещался эпидермисом. При морфометрии отмечалось уменьшение доли нейтрофилов за счет увеличения количества фибробластов. Количество макрофагов и лимфоцитов не имело статистически значимых отличий от этих показателей на 10-е сутки лечения. Число сосудов в поверхностных отделах дермы статистически значимо увеличилось по сравнению с предыдущим сроком (табл. 3.3).
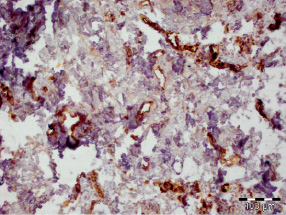
Рис. 3.9. Биоптат из края раны пациента 1-й группы на 20 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х200
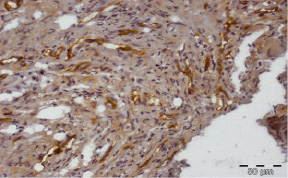
Рис. 3.10. Биоптат из края раны пациента 2-й группы на 20 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х400
У пациентов 3-й группы наблюдалось развитие грануляционной ткани под струпом, инфильтрированной нейтрофилами, макрофагами, лимфоцитами. Фибробласты располагались преимущественно вокруг сосудов. Наблюдались признаки краевой эпителизации. При изучении соотношения клеточных элементов в дерме отмечено увеличение доли фибробластов за счет снижения количества нейтрофилов, макрофагов и лимфоцитов (табл. 3.3).
У пациентов 4-й группы в биоптате из края раны определялось разрастание зрелой грануляционной ткани с интенсивной регенерацией покровного эпителия (рис. 3.9–3.12).
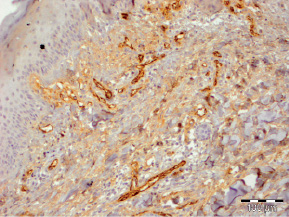
Рис. 3.11. Биоптат из края раны пациента 3-й группы на 20 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х200
Воспалительная инфильтрация была скудной, представлена преимущественно очаговыми паравазальными инфильтратами. В клеточном составе значительную долю занимали фибробласты и фиброциты. Наблюдалось большое количество анастомозирующих сосудов в поверхностных слоях дермы (табл. 3.3). При сравнении между собой морфологической картины и полученных данных у пациентов всех 4-х групп на 20 сутки после начала лечения, отмечен статистически значимый низкий уровень содержания гранулоцитов, макрофагов, лимфоцитов. Высокий уровень фибробластов в препаратах был у пациентов 4-й группы, которым проводили лечение озонотерапией и ультразвуком. Также у этих больных статистически значимо увеличилось количество сосудов на единицу площади. Следует отметить, что у пациентов 1-й группы количество макрофагов, фибробластов и сосудов статистически значимо было меньшим, чем у пациентов остальных групп, сохранялась инфильтрация нейтрофильными гранулоцитами. Между пациентами 2-й и 3-й групп определялось статистически значимое различие в количестве макрофагов и лимфоцитов. Статистически значимых отличий по количеству капилляров в дерме у пациентов этих групп не было.
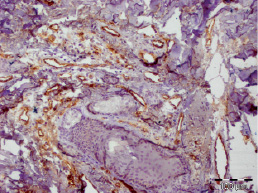
Рис. 3.12. Биоптат из края раны пациента 4-й группы на 20 сутки лечения. Экспрессия CD31 эндотелием сосудов. Ув. х200
Таким образом, анализ гистологических и морфометрических параметров свидетельствует, что у пациентов всех групп наблюдается положительная динамика при применении указанных способов лечения. Но скорость смены клеточного состава дермы, степень развития сосудистого русла и грануляционной ткани, выраженность эпителизации свидетельствуют, что наиболее эффективным является сочетание применения стандартной методики лечения с локальной обработкой раны озонированным маслом, дистиллированной водой и ультразвуком в (4-я группа пациентов).
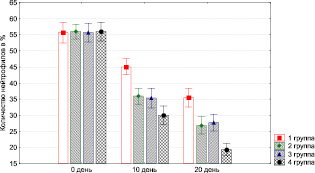
Рис. 3.13. Динамика изменения содержания нейтрофилов у экспериментальных животных
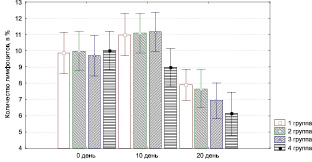
Рис. 3.14. Динамика изменения содержания лимфоцитов
у экспериментальных животных
При этом значительно уменьшается инфильтрация нейтрофильными гранулоцитами (рис. 3.13), макрофагами (рис. 3.15), лимфоцитами (рис. 3.14).
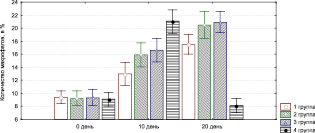
Рис. 3.15. Динамика изменения содержания макрофагов
у кспериментальных животных
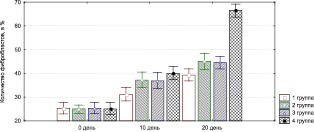
Рис. 3.16. Динамика изменения содержания фибробластов у экспериментальных животных
Отмечается активная пролиферация фибробластов (рис. 3.16) с восстановлением структуры соединительнотканного остова дермы, развивается сосудистая капиллярная сеть (рис. 3.17).
Наименее эффективной следует признать стандартную методику лечения с обработкой раны хлоргексидином и актовегином без
воздействия ультразвуком в 1-й группе, так как при этом длительно сохраняется полиморфно-клеточная воспалительная инфильтрация, отмечается слабый рост сосудов, низкая активность фибробластов (рис. 3.13–3.17). Присоединение к стандартной методике лечения обработки раны озонированным маслом, дистиллированной водой и ультразвуком значительно повышает эффективность лечения: по сравнению с другими группами быстрее снижается уровень нейтрофилов, более активно растут сосуды и т.п.
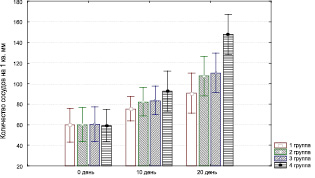
Рис. 3.17. Динамика изменения количества сосудов
у экспериментальных животных
Существенных морфологических различий в течении раневого процесса у пациентов 2-й и 3-й групп не отмечено (рис. 3.9–3.12).