
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.3.1. Рецептор лигандов семейства паратиреоидного гормона первого типа (PTHR1)
ПТГрП взаимодействует с клеточными мембранами через общий рецептор с ПТГ, а также через специфические рецепторы (J́üppner H. et al., 1991; Lanske B. et al., 1966; Lanske B. et al., 1998; Gensure R.C. et al., 2005). Организация гена рецептора ПТГ/ПТГрП 1-го типа (PTHR1) очень гомологична у трех видов млекопитающих, а именно у крысы, человека и мыши. Этот ген простирается более 22 кб и, что указывает на существование широких возможностей альтернативного сращивания транскриптов (Orloff J.J. et al., 1994). У людей ген, кодирующий PTHR1, расположен на хромосоме 3p и состоит из 14 кодирующих экзонов. Зрелая мРНК кодирует белок, состоящий из 593 аминокислот, включая N-концевой сигнальный пептид из 22 аминокислот, который удаляется во время внутриклеточной обработки. Основная белковая топология определяется относительно крупным N-концевым внеклеточным доменом из 165 аминокислот, областью трансмембранного домена, и C-концевым доменом содержащим около 130 аминокислот (Gardella T.J., Vilardaga J.P. 2015).
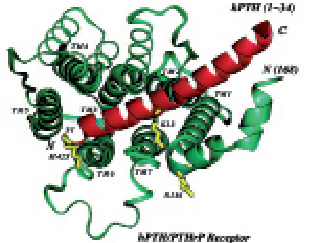
Рис. 5. Кристаллическая структура ПТГ/ПТГрП рецептора человека
Общий ПТГ/ПТГрП-рецептор специфически взаимодействует с N-концевым доменом обеих молекул. Рецептор ПТГ/ПТГрП (PTHR1) принадлежит к определенному классу гептагелических G-белков, к которым также относятся рецепторы секретина, кальцитонина, глюкагона и ряда других пептидных гормонов (J́üppner H., 1999), которые взаимодействуют с NH2-терминальными 34 аминокислотными доменами как ПТГ, так и ПТГрП (PTHR1) или только ПТГ (PTHR2). ПТГрП имитирует почти все функции ПТГ, которые опосредованы взаимодействием N-терминального домена с рецептором и последующей активацией внутриклеточных сигнальных путей. Мембранный рецептор ПТГрП/ПТГ относится к семейству ПТГ суперсемейства В, входящего в класс G-протеин-сопряженных рецепторов (G-ПСР) (по данным Европейского института биоинформатики (Хинкстон, Великобритания) и Информационного ресурса белков (PIR) (Вашингтон, США) (релиз 56.7 от 2001 до 2009 г.). Рецепторы класса G-ПСР представляют собой полипептидную цепь с N- и C-кольцевыми свободными доменами, экстра-интрацеллюлярными петлями и семью трансмембранными доменами (Shigeta R. et al., 2003).
Cвязывание G-ПСР с агонистом может активировать или угнетать многие цитоплазматические эффекторные протеины: анденилатциклазы 1-9, фосфолипазы С и В, тирозинкиназы, фосфоинозитид 3-киназу и ионные каналы (Cabrera-Vera T.M. et al., 2003). ПТГрП проявляет большую вариабельность в отношении эффектов на клетки – мишени запуская в них различные механизмы внутриклеточной передачи сигнала (Abou-Samra A.B. et al., 1992). ПТГрП способен индуцировать внутриклеточный Са++-сигнал через транзиторное открытие каналов L типа Са++, тем самым влияя на экспрессию генов, промотеры которых содержат Са++-реагирующие элементы и/или другие внутриклеточные пути, зависящие от Са++-кальмодулина (Alokai M.S., 2007; Valín A. et al., 2001; Whitfield J.F., 2007) (рис. 6).
Большой N-концевой экзодомен рецептора участвует во взаимодействии с лигандами, а С-концевой домен отвечает за активизацию внутриклеточного сигнального каскада (Cardoso J.C. et al., 2006; Gardella T.J., J́üppner H., 2001; J́üppner H. et al., 1991; Harmar A.J., 2001). ПТГ/ПТГрП – рецептор обнаружен практически во всех исследованных тканях (Schĺüter K.D., 1999).
Он связывается c N-концевыми доменами ПТГ (1-34) и ПТГрП (1-36), активирует аденилатциклазный-протеинкиназный А, либо фосфолипазный-протеинкиназный С внутриклеточные сигнальные пути (Abou-Samra A.B et al., 1989; Zuscik M.J. et al., 2002; Li T.F. et al., 2004) и это единственный клонированный рецептор для ПТГрП (Clemens T.L. et al., 2001; Juppner H. et al., 1991). N-концевые пептидные фрагменты ПТГ и ПТГрП являются достаточными для связывания и активации ПТГ/ПТГрП-рецептора в той же степени, что и нативные молекулы. У млекопитающих активация ПТГ/ПТГрП-рецептора доменами ПТГ-(1-34) и ПТГрП-(1-34) сравнима с активацией соответствующими полноразмерными протеинами (Moseley J.M., Gillespie M.T., 1995; Blind E. et al., 1993). И ПТГ-(1-34) и ПТГрП- (1-34) одинаково эффективны для активации сигнализации цАМФ (Juppner H. et al., 1991). Их взаимодействие с рецептором происходит по «двухдоменной» схеме. Остатки 1-14 взаимодействуют с 7-м трансмембранным доменом, встроенным в мембрану, а остатки 15-34 взаимодействуют с N-концевым внеклеточным доменом рецептора (Bergwitz C. et al., 1996; Luck M.D. et al., 1999). Фрагменты ПТГ (1-14) и ПТГрП (1-14) имеют восемь идентичных аминокислотных последовательностей, отражающих критическую роль, которую этот фрагмент играет при активации рецептора (Luck M.D. et al., 1999). Основные связывающие домены ПТГ и ПТГрП принимают аналогичные конформации, когда связываются с рецептором, что в значительной степени подтвержденос помощью последних кристаллографических исследований каждого из лигандов (Gardella T.J., Vilardaga J-P., 2015).
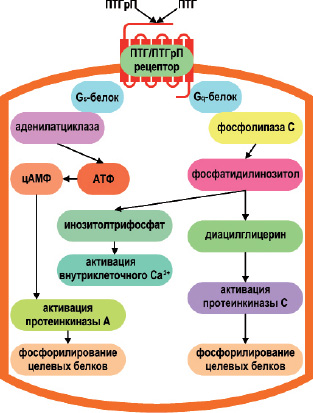
Рис. 6. Трансдукции сигнального пути в лиганд-индуцированной активации ПТГ/ПТГрП-рецептора (PTHR1). Связывание лиганда приводит к ассоциации с Gs α-субъединицы G-белка и активации аденилатциклазы, или с Gq α-субъединицы G-белка, который активирует фосфолипазу С. ПТГрП проявляет большую вариабельность в отношении эффектов на клетки – мишени запуская в них различные механизмы внутриклеточной передачи сигнала, активируя или угнетая ряд цитоплазматических эффекторных протеинов, а также индуцируя внутриклеточный
Са++-сигнал через транзиторное открытие каналов L типа Са++
Несмотря на общий механизм связывания двухдоменных рецепторов, сходную вторичную структуру и эквипотентную активацию сигнализации, ПТГ и ПТГрП отличаются способностью связываться с двумя фармакологически различными версиями ПТГ/ПТГрП-рецептора, которые отличаются наличием или отсутствием связывания с белком G. Пептиды связывают с высоким сродством с рецептором, связанным с белком G (конформационное состояние RG), но в отсутствие связи G-белка (конформационное состояние R0) связывание ПТГрП значительно уменьшается, тогда как связывание ПТГ лишь незначительно уменьшается (Dean T. et al., 2008; Dean T. et al., 2006; Hoare S. et al., 2001). Таким образом, ПТГрП более RG-селективен, чем ПТГ. Различные профили селективности R0/RG ПТГ и ПТГрП коррелируют с различными временными эффектами на сигнализацию цАМФ. ПТГ вызывает более длительный сигнал цАМФ после лиганд-рецепторного взаимодействия, чем ПТГрП (Dean T. et al., 2008). Дивергентный остаток 5 (Ile в ПТГ, His в ПТГрП) является ключевым определителем различий селективности R0/RG пептидов (Dean T. et al., 2008; Hoare S.R. et al., 2001). PTH и PTHrP демонстрируют различную селективность для двух различных конформаций PTH1R, но то, как их связывание с рецептором отличается, неясно. Кристаллическая структура высокого разрешения ПТГрП, связанная с внеклеточным доменом PTHR1, показывает (рис. 7), что ПТГрП связывается как амфипатическая альфа-спираль с той же гидрофобной канавкой в внеклеточным домене, что и ПТГ, но в отличие от прямой непрерывной спирали ПТГ, спираль ПТГрП мягко изогнута и C-терминально «размотана».
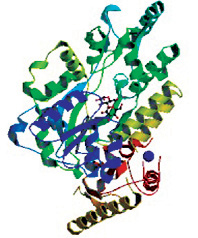
Рис. 7. Кристаллическая структура внеклеточного домена рецептора PTHR1 в комплексе с белком, родственным паратиреоидному гормону (ПТГрП). PDBe > 3h3g.(Pioszak A.A., Parker N.R., Gardella T.J., Xu H.E. J Biol Chem. 2009; 284: 28382-28391
Рецептор вмещает измененные режимы связывания путем смещения конформаций боковых цепей двух остатков в канавке связывания: Leu-41 и Ile-115, причем первый действует как поворотный переключатель для размещения расхождения ПТГ/ПТГрП, а последний адаптируется к кривизне ПТГрП (Pioszak A.A. et al., 2009).
В некоторых тканях ПТГрП также связывается с рецептором, который не связывает ПТГ. В одних и тех же клетках могут присутствовать рецептор, взаимодействующий с ПТГрП (1-36) и другой рецептор, лигандом которого является ПТГрП (67-86) (Orloff J.J. et al., 1996). Предполагается связывание фрагментов (1-14) и (15-34) домена ПТГрП (1-34) с рецептором ПТГ/ПТГрП и прямым или косвенным участием His-5, Arg-19 иArg-21 в этом взаимодействии (Gardella T.J. et al., 1995). Установлено, что COOH-концевой домен человеческого ПТГрП (1-34) участвует в связывании рецепторов, тогда как NH2-терминальный домен Ala-1-Ser-14 инициирует каскад передачи сигналов (Botella A. et al., 1994).
Предполагается, что первоначальное связывание рецептора с СООН-концевым фрагментом облегчает взаимодействие рецептора с NH2-концевой спиралью. Взаимодействие между двумя спиралями белка может быть необходимым для реализации биологической активности и может быть индуцировано при связывании рецептора (Gardella T.J. et al., 1995). В виду множественных функций ПТГрП, опосредованных его NH2-терминальным фрагментом (1-34), определение третичной структуры этого белка представляет значительный биохимический и медицинский интерес. Аналоги нативных лигандов ПТГ/ПТГрП-рецептора, такие, как PTH (3-34), PTH (7-34), [Phe3] и [Phe6] PTH, [D-Trp12, Tyr34], PTH (7-34), PTHrP (7-34), [D-Trp12] PTHrP (7-34), [Asn10, Leu11] PTHrP (7-34), [Asn10, Leu11, D-Trp12] PTHrP (7-34), [Ile5, Trp23] PTHrP (1-36), TIP (7-39) и TIP (9-39) связываются с этим рецептором с высокой аффинностью, но вызывают незначительную сигнальную трансдукцию, действуя как сильные антагонисты (Jonsson K.B. et al., 2001; Nutt R.F. et al., 1990; Pizurki L. et al., 1990; Carte P.H. et al., 1999; Cohen F.E. et al., 1991). Функциональное тестирование с использованием усеченных форм ПТГрПпоказало, что эти пептиды не смогли вызвать синтез цАМФ, но могли стимулировать фосфолипазу C. Таким образом, первые несколько остатков имеют важное значение для пути cAMФ, но не для связывания рецептора (Rotllant J. et al., 2005). Эти свойства усеченного ПТГрП-(7-34) использовали для развития антагонистов ПТГ/ПТГрП-рецептора (Gardella T.J. et al., 1996).
ПТГ (1-31) и ПТГ (1-28) являются самыми короткими нативными пептидами, которые поддерживают полную аффинность рецепторов и мощность сигнала (Whitfield J.F., Morley P., 1995; Whitfield J.F., Bringhurst F.R., 2000), тогда как ПТГ (1-14) является самым коротким нативным N-концевым пептидом, для которого существует некоторая агонистическая активность (Luck M.D. et al., 1999). Остатки в позициях 1-9 образуют ключевой домен активации рецептора, а аминокислотные замены в этих положениях повышают эффективность до 25 раз, а также активируют неактивный нативный пептид ПТГ (1-11) (Shimizu M. et al., 2000).
Многогранность эффектов ПТГрП связана с его способностью взаимодействовать с несколькими типами рецепторов. ПТГрП (107-139) может активировать сигнальные пути через протеинкиназу С. (De Gortazar A.R. et al., 2006). Это рассматривается как свидетельство того, что срединный (midregion) и С-концевой домены ПТГрП связываются с другими типами рецепторов, которые еще не идентифицированы и не клонированы (Orloff J.J. et al., 1994). Клетки мозга (Yamamoto S. et al., 1997), клетки инсулиномы (Gaich G. et al., 1993) и клетки кожи (Orloff J.J. et al., 1992) имеют рецепторы, которые специфичны для аминоконцевого фрагмента ПТГрП и, которые не распознают паратиреоидный гормон. Существует также свидетельство существования рецептора С-концевого фрагмента белка, родственного паратиреоидному гормону, в мозге (Fukayama S. et al., 1995) и предположительно в кости, где этот фрагмент, иногда называемый остеостатином, по-видимому, ингибирует резорбцию кости (Fenton A.J. et al., 1991; Cornish J. et al., 1997).
Было показано, что мРНК рецепторов ПТГ/ПТГрП в почках экспрессируется с почечноспецифического промотора P1 и промотора P2, активного во многих типах тканей. Иммуноцитохимический и иммуноэлектронномикроскопический анализы показали, что рецепторы ПТГ/РПТГП в почках мышей локализуются в апикальной и базолатеральной мембранах клеток эпителия проксимальных почечных канальцев. Иммунореактивные рецепторы ПТГ/ПТГрП обнаружены также на поверхности гломерулярных подоцитов и в клетках эндотелия перитубулярных сосудов, но не гломерулярных сосудов. В кортикальных и медуллярных эпителиальных клетках нефрона обнаружили экспрессию рецепторов ПТГ/ПТГрП как типа P1, так и типа P2, а в клетках перитубулярного эндотелия обнаружили только рецепторы типа P1 (Amizuka N. et al., 1997). Изучение в эксперименте механизмов регуляции экспрессии гена этого рецептора показало, что удаление паращитовидных желез не изменяет содержание мРНК рецепторовПТГ/ПТГрП в почках, сердце и печени (Smogorzewski M. et al., 1997).
Рецепторы ПТГ/ПТГрП (PTHR1) присутствуют в нормальной ткани предстательной железы, тонкой, толстой и прямой кишки, в коре надпочечников (Martin T.J. et al., 1997). Ohguchi H. et al. (2017) выявили экспрессию ПТГ/ПТГрП рецепторов в нейронах миоэнтерического сплетения. В костной ткани рецепторы ПТГрП первого типа были обнаружены в остеоцитах и остеобластах, но не в остеокластах (Lupp A. et al., 2010). У человека рецептор ПТГ/ПТГрП также экспрессируется во множестве других тканей, активируется ПТГ и ПТГрП, и участвует в реализации аутокринных, паракринных и эндокринных эффектов (Gensure R.C. et al., 2005; Schneider H. et al., 1993; Usdin T.B. et al., 1995).
Транскрипты рецептора ПТГ/ПТГрП высоко экспрессируются в тканях-мишенях ПТГ почках и костях. Однако транскрипты рецептора также выражены во многих других тканях, включая аорту, надпочечник, мочевой пузырь, мозг, мозжечок, молочные железы, сердце, подвздошную кишку, печень, легкие, скелетную мышцу, яичник, плаценту, кожу, селезенку, желудок, матку и яички (Urena P. et al., 1993).
Рецепторы для ПТГрП присутствуют в кишечном эпителии (Li H. et al., 1995). Возможно, что этот белок играет физиологическую роль в развивающемся пищевом тракте или используется для выполнения других функций. У рыб, рецептор ПТГ/ПТГрП в основном экспрессируется в печени, гонадах, коже, головном мозге и гипофизе (Guerreiro P.M. et al., 2007; Hang X.M., et al., 2005; Rotllant J., et al., 2005). В личинках морского леща экспрессия мРНК рецептора ПТГрП обильна в хлоридных клетках кожного покрова, в осевых мышечных клетках и, в меньшей степени, в глазу (Power D.M. et al., 1999). Наивысшая экспрессия ПТГ/ПТГрП (PTHR1), определяемая количественной-ПЦР, была обнаружена в печени и гонадах морского леща, за которыми следуют кожа, мозг и гипофиз (Hang X.M., et al., 2005). Также широко распространена экспрессия генов рецептора ПТГрП в клетках эпителия кишечника тетраподовых (Li H. et al., 1995). Наличие ПТГрП и его рецепторов практически в каждом органе в период развития организма и во взрослой жизни предполагает, что передача сигналов ПТГрП имеет место в различных физиологических условиях.
Дефекты в этом рецепторе являются причиной метафизарной хондродисплазии Янсена (JMC) [MIM: 156400], хондродисплазии типа Бломстранда (BOCD) [MIM: 215045], первичного отказа от извержения зуба (PFE) [MIM: 125350], скелетной дисплази Eiken (EISD) [MIM: 600002], а также энходроматоза [MIM: 166000]. Все пять нарушений PTH1R характеризуются различными дефектами развития скелета. Однако генетическая основа этих заболеваний различна (Jobert A.S. et al., 1998; Karaplis A.C. et al., 1998; Zhang P. et al., 1998; Couvineau A. et al., 2008; Duchatelet S. et al., 2005; Schipani E. et al., 1995). Мутации в гене PTHR1 были связаны с первичной недостаточностью извержения (PFE) зубов, характеризующейся тяжелым задним открытым прикусом, вызванным проблемами с движением зубов от места их развития в альвеолярной кости до функционального положения в полости рта (Pilz P. et al., 2014)
Роль генетических дефектов рецептора ПТГ/ПТГрП в хондродисплазии была продемонстрирована в исследованиях (Ogata N., 2010). Генетические манипуляции с ПТГрП и его рецепторными генами у мышей продемонстрировали критическую роль этих белков в регулировании переключения между пролиферацией и дифференцировкой хондроцитов. Hopyan S. et al. (2002) идентифицировали мутантный рецептор ПТГ/ПТГрП (PTHR1) в очагах энхондроматоза человека, который вызывает энхондромоподобные поражения у трансгенных мышей. Мутантный рецептор конститутивно активирует сигнальный белок Indian hedgehog (Ihh), чрезмерная сигнализация которого является достаточной, чтобы вызвать образование локальных очагов поражения. Энхондромы, как правило, находятся в непосредственной близости от хрящевой пластины роста. Допускается, что, они могут быть результатом аномальной регуляции пролиферации и терминальной дифференциации хондроцитов в прилегающем к пластине роста локусе (Hopyan S. et al., 2002).
Rozeman L.B. et al. (2004) исследовали PTHR1 в энхондромах и хондросаркомах у 31 пациента с энхондроматозом из трех разных европейских стран, тем самым исключая предвзятость населения. Экспрессию белка PTHR1 изучали с использованием иммуногистохимии, выявляя нормальную экспрессию. Присутствие описанной мутации PTHR1 анализировали, используя аллельспецифическую олигонуклеотидную гибридизацию, подтвержденную анализом последовательности, в опухолях у 26 пациентов. Кроме того, 11 пациентов были подвергнуты скринингу на другие мутации в гене PTHR1 путем анализа последовательности. Используя как аллельспецифическую олигонуклеотидную гибридизацию, так и секвенирование, авторы не смогли ни подтвердить ранее обнаруженную мутацию, ни найти какие-либо другие мутации в гене PTHR1. Эти результаты показывают, что ген PTHR1 вероятно не является, в отличие от предыдущих предположений, причиной развития энхондроматоза.
Энхондроматоз включает в себя несколько различных подтипов, среди которых наиболее распространены болезнь Оллиера и синдром Маффуччи, а другие подтипы (метахондроматоз, генохондроматоз, спондилоенхондродисплазия, дисспондилоенхондроматоз и хейроспондилохондроматоз) встречаются крайне редко. Большинство подтипов не являются наследственными, а некоторые являются аутосомно-доминантными или рецессивными. Предполагается, что ген (ы), вызывающий разные подтипы энхондроматоза, участвуют в сигнальных эффектах Ihh на PTHR1 в ростовой пластине (Pansuriya T.C. et al., 2010).
Болезнь Оллиера и синдром Маффуччи – это редкие, скелетные расстройства, характеризующиеся наличием множественных энхандромов с (Maffucci) или без (Ollier) сосуществующих множественных гемангиом мягких тканей (Pansuriya T.C et al., 2011). Гетерозиготные мутации PTH1R идентифицированы примерно у 10 % пациентов с болезнью Оллиера. Сообщалось об активации мутации в гене рецептора PTHR1 (p.R150C). Считается, что мутация приводит к усилению пути Ihh/ПТГрП (Hopyan S. et al., 2002). В последующем исследовани Couvineau A. et al. (2008) для дальнейшего определения роли PTHR1-сигнального пути в болезни Оллиера и синдроме Маффуччи был проведен анализ кодирующие последовательности генов PTHR1, Ihh, ПТГрП в лейкоцитах и/или опухолевой ДНК пациентов, страдающих от болезни Оллиера или синдрома Маффуччи. Авторы идентифицировали три ранее неописанные гетерозиготные миссенс-мутации в PTHR1 у пациентов с болезнью Оллиера. Две мутации (p.G121E, p.A122T) присутствовали только в энхондромах и одна (p.R255H) как в энхондроме, таки в лейкоцитарной ДНК. Оценка рецепторной функции показала, что эти три мутации ухудшают функцию PTHR1, уменьшая либо плотность рецептора для ПТГрП, либо экспрессию рецептора на поверхности клетки. Эти мутации не были обнаружены в ДНК из 222 контролей. Полученные данные позволили сделать вывод, что мутации PTHR1, связанные с болезнью Оллиера, приводят к потере функции рецептора, уменьшая рецепторную функцию до ~70 %. Авторы полагают, что это может способствовать заболеванию, но, вероятно, не является его причиной. Pansuriya T.C. et al. (2011) представили первый анализ генома крупнейшей международной серии исследования болезни Оллиера, являющейя наиболее распространенным подтипом энхондроматоза. Полученные геномные профили показали отсутствие больших генетических аберраций при болезни Оллиера.
Рецессивные мутации в PTHR1 вызывают контрастные скелетные дисплазии в синдромах Эйкена и Бломстранда. Duchatelet S., et al. (2005) идентифицировали мутацию в С-концевом цитоплазматическом домене гена рецептора ПТГ/ПТГрП 1 типа (PTHR1) в качестве причины синдрома Эйкена. Синдром Эйкена отличается от хандродисплазии Янсена и Бломстранда и энхондроматоза, которые являются синдромами, вызванными мутациями PTHR1. Установлено, что скелетные особенности противоположны тем, что присутствуют в хондродисплазии Бломстранда, что обусловлено инактивацией рецессивных мутаций в PTHR1.
Тот факт, что COOH-концевые области ПТГ и ПТГрП имеют функции отличающиеся от тех, которые опосредованы известными рецепторами ПТГ/ПТГрП, предполагает, что для этих фрагментов могут существовать другие рецепторы (Gensure R.C. et al., 2004). ПТГ и ПТГрП связываются у млекопитающих с ПТГ/ПТГрП с неразличимой аффинностью и оба лиганда стимулируют аденозин 3′, 5′-циклический монофосфат (цАМФ) и инозитол 1,4,5-трифосфат (IP3) с эквивалентной эффективностью (Juppner H., 1999).