
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
5.3. Роль паратгормон-родственного протеина в костном метастазировании злокачественных новообразований
ПТГрП отводится значительная роль в патофизиологии костных метастазов. Скелетные метастазы многих видов опухолей характеризуются как увеличением скорости резорбции кости, так и интенсивности формирования костной ткани взамен разрушенной. Интенсивный характер костного метаболизма с избыточной резорбцией костной ткани является архетипической чертой большинства, если не всех, костных метастазов (Roodman G.D., 2004). Молекулярные механизмы метастазирования опухолей сложны, включают ряд последовательных событий и взаимосвязанных факторов. Несмотря на интенсивные исследования, молекулярные механизмы, лежащие в основе метастазирования, все еще остаются недостаточно изученными (Clarke N.W., et al., 2009).
Известно, что ПТГрП играет важную роль в молекулярных механизмах костного метазирования рака предстательной железы (Clarke N.W., et al., 2009; Sekita A., et al., 2017), рака легкого (Kuo P.L., et al., 2013), рака молочной железы (Wang Y., et al., 2014; Azim H.A., et al., 2012; Guise T.A., et al., 2005), а также многих других видов опухолей (Wysolmerski J.J., 2012). ПТГрП оказывает сложное многофакторное влияние на процесс скелетного метастазирования различных видов опухолей: модулирует микросреду костной ткани и способствует автономному функционированию опухолевых клеток и, в том числе, их росту и прогрессии (Soki F.N., et al., 2012) (рис. 14).
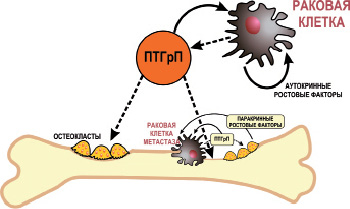
Рис. 14. Влияние ростовых факторов на продукцию ПТГрП в опухолевых состояниях. Опухолевые клетки находящиеся на расстоянии от кости могут быть стимулированы аутокринными факторами роста, чтобы увеличить производство ПТГрП, который затем может перемещаться к костям с посредством гемо- и лимфоциркуляции и повышать резорбцию кости. Опухолевые клетки костных метастазов могут секретировать ПТГрП, который может стимулировать резорбцию костной ткани и продуцировать факторы роста. Эти ростовые факторы могут действовать паракринным образом
для дальнейшего повышения производства ПТГрП, который сам по себе может способствовать росту и прогрессии опухоли
ПТГрП рассматривается, как ключевой фактор при скелетных осложнениях, связанных с метастазами солидных опухолей в кости. Этот плейотропный протеин оказывает свои действия локально на опухолевые и стромальные клетки паракринно, аутокринно и интракринно кости. ПТГрП регулирует взаимодействия опухолевых и стромальных клеток, а также непосредственно участвует в туморогенезе влияя на пролиферацию раковых клеток (Wright, L.E., Guise, T.A., 2014).Так как костным метастазам требуется взаимодействие между опухолевыми клетками и клетками костной ткани, то остеоциты в качестве ПТГрП-реагирующих клеток, могут играть определенную роль в модуляции микросреды с секрецией различных факторов роста, опосредующих рост опухоли.
Метастатическая колонизация отдаленных органов требует распространения опухолевых клеток обладающих способностями к выживанию в кровеносном русле, вторжению во внеклеточный матрикс, и адаптации к новой среде (Rahim F., et al., 2014). В связи с этим, опухолевые клетки продуцируют многочисленные костные модулирующие цитокины, включая ПТГрП, остеопротегерин, лиганд рецептора активатора ядерного фактора-kB (RANKL), и другие (Deftos L.J., et al., 2005).
Продукция ПТГрП коррелирует с прогрессированием костных метастазов солидных опухолей, что связанно с влиянием этого белка на микроокружение метастазов и, в том числе, на остеобласты. При введении под кожу бестимусным мышам выскоэкспрессивных клеток рака простаты наблюдали образование опухолей бóльших размеров по сравнению с размерами опухолей, сформировавшихся у мышей, которым вводили опухолевые клетки с меньшей способностью к экспрессии ПТГрП. Введение ПТГрП в костную ткань совместно с опухолевым имплантом вызвало значительное увеличение костной массы, прилегающей к очагам опухоли с гиперэкспрессией ПТГрП (Liao J., et al., 2008).
Установлено, что ПТГрП вызывает усиленную пролиферацию стромальных клеток костного мозга и раннюю дифференциацию остеобластов. ПТГрП оказывал проангиогенный эффект косвенно, поскольку ангиогенез усиливался только в присутствии стромальных клеток костного мозга. Полученные данные позволили сделать вывод, что ПТГрП – ключевой посредник взаимодействия между клетками костных метастазов, клеточными элементами собственно костной ткани и пулом сигнальных биомолекул различной природы (Liao J., et al., 2008).
Продуцируемый опухолью ПТГрП может действовать различными способами, чтобы модулировать рост опухоли, прогрессирование и метастазирование. Когда опухоль метастазирует в кости ПТГрП действует паракринно в костной микросреде, активируя остеобласты. Кроме того, опухолевые клетки также продуцируют ПТГ/ПТГрП-рецептор, участвующий в реализации аутокринных эффектов ПТГрП и способствующий росту и пролиферации клеток. И, наконец, ПТГрП также действует интракринным образом, увеличивая выживаемость клеток и их устойчивость к апоптозу (Fiaschi-Taesch N.M., Stewart A.F., 2003). Существующие данные подтверждают гипотезу о том, что ПТГрП также изменяет микросреду опухоли, потенциально способствуя развитию метастазов. В соответствии с гипотезой Стивена Педжета о метастазировании опухолей (гипотеза о «семенах и почве») диссеминированные опухолевые клетки («семена») могут сформировать метастазы только тогда, когда они попадают в «правильную почву» (Fidler I.J., 2003; Paget S., 1989).
ПТГрП в скелетных метастазах обладает способностью действовать на оба компонента процесса, подготавливая «семена» (опухолевые клетки) и «почву» (костную микросреду). Взаимодействие опухолевых клеток с костной микросредой важнейшее условие роста опухоли и ремоделирования кости в процессе скелетного метастазирования (Weilbaecher K.N., et al., 2011). Опухолевые клетки секретируют такие факторы, как ПТГрП, TNF-alpha, IL-1, IL-6, IL-8 и IL-11, которые стимулируют костные клетки. В свою очередь, активированные остеобласты и остеокласты секретируют другие факторы, которые способствуют росту опухоли и поддерживают разрушительный каскад метастатического роста (Chirgwin J.M., Guise T.A., 2007). ПТГрП может выступать в качестве эндокринного или паракринного фактора, модулирующего клеточные аспекты костной микросреды, тем самым способствуя формированию благоприятных условий для метастазирования рака в кости.
Рентгенологические проявления костных метастазов имеют различные характеристики. При остеобластических по структуре метастазах фиксируется повышенная активность остеобластов и формирование аномальной кости. При остеолитических метастазах отмечается усиление активности остеокластов и выявляется аномальная резорбция кости (Weilbaecher K.N., et al., 2011; Loberg R.D., et al., 2005) (рис. 15).
ПТГрП может активировать локальный остеолизис в участках кости, прилегающих к костным метастазам, что создает благоприятные условия для их развития и таким образом ПТГрП участвует в аутокринной регуляции роста опухоли. Наиболее выражена взаимосвязь инвазивного фенотипа опухоли и развития костного метастазирования с присутствием изоформы ПТГрП (1-139). ПТГрП является эффектором трансформирующего фактора роста (TGF-beta), участвующеего в развитии и прогрессировании остеолитических костных метастазов. Этот ростовой фактор, высвобождающийся из костной матрицы во время остеолитической резорбции костной ткани, индуцирует образование ПТГрП в опухолевых клетках. Затем этот белок стимулирует разорбцию костной ткани, что повышает потенциал развития костных метастазов (Devys A., et al., 2001).
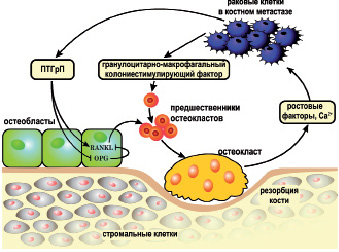
Рис. 15. Роль ПТГрП в развитии костных метастазов по механизму «порочный круг». Костный метастаз может развиваться через ряд взаимодействий в мнкроокружении опухоли, известные как «порочный круг»: в этом цикле ПТГрП играет важную роль. Опухолевые клетки секретируют факторы, которые стимулируют активацию остеобластов и остеокластов. Активированные остеокласты деградируют матрицу кости и продуцируют факторы, которые стимулируют клетки опухоли. Метастатические опухолевые клетки взаимодействуют с костной микросредой для облегчения остеолитической колонизации. Опухолевые клетки секретируют ПТГрП, который стимулирует остеобласты, чтобы производить как один из ключевых активаторов остеокластов мембранно-связанный цитокин RANKL, так и растворимый рецептор приманку для RANKL остеопротогерин (OPG). Это соотношение RANKL к OPG определяет активацию остеокластов через его рецептор для RANKL. Активированные остеокласты деградируют матрицу кости, продуцируя в местное микроокружение факторы роста, стимулирующие опухолевые клетки для продолжения секреции ПТГрП и тем самым замыкая «порочный круг» и возобновляя цикл взаимодействий в мнкроокружении опухоли
Ангиогенез представляет собой хорошо изученный процесс поддержки роста и прогрессии опухоли. Появляется все больше свидетельств того, что ПТГрП может повлиять на развитие костных метастазов с помощью стимуляции ангиогенеза. Недавнее исследование с использованием модели спонтанного рака молочной железы у мышей со специфической делеции гена ПТГрП, показало, что экспрессия ПТГрП влияет не только на инициацию опухоли, ее прогрессирование и метастазирование, но и на ангиогенез опухоли. ПТГрП паракринно стимулировал ангиогенез костных метастазов. Проангиогенный эффект ПТГрП зависел от наличия стромальных клеток костного мозга (Liao J, et al., 2008). ПТГрП абляция приводит к снижению ангиогенеза (Li J., et al., 2011). Показано, что ангиогенный эффект ПТГрП зависит от активности остеокластов и продукции MMP9 (Cackowski F.C., et al., 2010). ПТГрП активирует клетки костной микросреды, стимулируя ангиогенез и, таким образом способствует метастатическому росту костной ткани.
ПТГрП широко исследуется в качестве важного фактора при пухолях, которые имеют значительный костный тропизм, особенно при раке простаты и молочной железы. Кости являются общим местом для опухолевых метастазов, и скелетные метастазы являются одной из основных причиной смертности среди пациентов с раком молочной железы, простаты и рака легких. Примерно 70 % умерших больных раком молочной железы и около 90 % больных раком простаты имели признаки костных метастазов (Coleman R.E., 2006; Bubendorf L., et al., 2000).
Рак простаты отличается выраженной склонностью к метастазированию в кости (Dougherty K.M., et al., 1999). Более 70 % пациентов с раком предстательной железы имеют на поздней стадии заболевания костные метастазы, что существенно снижает качество жизни (Mundy G.R., 2002; Roodman G.D., 2004). Костные метастазы различных видов рака часто растут более быстрыми темпами, чем первичная опухоль или метастазы другой локализации, что определяется наличием факторов, которые способствуют росту или ингибируют гибель клеток опухоли. Метастазы преимущественно локализуются в регионах с высоким уровнем метаболизма костной ткани (Schneider A., et al., 2005). Сообщалось об увеличенной экспрессии рецептора ПТГрП в костных метастазах рака предстательной железы по сравнению с первичными опухолями, что указывает на потенциальную роль рецептор-опосредованных механизмов в формировании скелетных метастазов (Iddon J., et al., 2000; Roodman G.D., 2004).
Клетки рака простаты способны к высокой степени адгезии и локализации в участках костной ткани с активным ремоделированием, которое, регулируется с участием ПТГрП (Mak I.W., et al., 2013). ПТГрП активизирует различные митогенные пути, и, в том числе, способствовует эпителиально-мезенхимальному переходу, в раковых стволовых клетках, что стимулирует костное метастазирование опухолей (Ongkeko W.M., et al., 2014).
Значение микросреды костной ткани в регионах скелета, имеющих метастазы, становится все более очевидным, поскольку данных, свидетельствующих о существовании значительных изменений нормального ремоделирования кости у онкобольных становится все больше. В норме процессы формирования костной ткани остеобластами и резорбции старых костных структур остеокластами взаимосвязаны во времени и в пространстве последовательностью событий, определяющих процесс ремоделирования костной ткани. При наличии в костных структурах метастазов в зоне костной ткани, примыкающей к очагу неопластического процесса, нарушается нормальная регуляция процессов образования костной ткани и ее резорбции (Zafeirakis A., 2010). Для того, чтобы создать пространство для своего роста, клетки метастаза опухоли стимулируют резорбцию костной ткани остеокластами.
Цитокин RANKL является одним из ключевых активаторов остеокластов, в то время как остеопротегерин представляет собой рецептор, конкурирующий с RANK за RANKL, и поэтому является ингибитором остеокластогенеза. RANK/RANKL/OPG сигнальный путь является важнейшим регуляторным механизмом определяющим дифференцировку и активацию остеокластов в процессе ремоделирования костной ткани как в физиологических условиях так и при патологических процессах ассоциированных с опухолевым ростом и развитием метастазов (Baud′huin M., et al., 2007). Остеопротегерин (ОПГ) уменьшает онкоиндуцированное разрушение кости. Было предположено, что ОПГ, вырабатываемый клетками костного метастаза, вызывает локальное снижение уровня RANKL, формируя более крутой градиент RANKL от опухоли к костной ткани, что приводит к более быстрой резорбции и росту опухолей. Эта гипотеза была проверена с помощью математической модели на основе системы нелинейных дифференциальных уравнений, описывающих пространственную динамику OПГ, RANKL, ПТГрП, остеокластов, массы опухоли и костной массы. Показано, что экспрессия опухолью ПТГрП, индуцирующего RANKL, имеет важное значение для правильной ориентации градиента RANKL. Мета-анализ продукции OПГ, RANKL и ПТГрП в клетках нормальный простаты, клетках рака железы и в ткани ее метастазов продемонстрировал увеличение экспрессии OПГ, но не RANKL, а также положительную корреляцию между ОПГ и ПТГрП в метастазах рака предстательной железы (Ryser M.D., et al., 2012).
Известно, что костные метастазы РПЖ отличаются от костных метастазов других видов рака выраженной минерализацией ткани опухоли. При этом рентгенологически часто фиксируется склерозирование участков пораженной кости, формирующееся на фоне относительного превалирования процессов остеогенеза над процессами костной резорбции (Seibel M.J., 2005). Механизмы этого до настоящего времени недостаточно понятны, что обуславливает их активное изучение. Предполагается, что избыточная минерализация ткани костных метастазов связана с анаболическими эффектами прерывистого воздействия ПТГрП.
В отличие от метастазов при раке легких или молочной железы, которым присущи остеолитические повреждения, костные метастазы при РПЖ являются преимущественно бластными, хотя они также содержат остеорезорбтивный компонент (Morris M.J., Scher H.I., 2003). Остеобластные метастазы при РПЖ происходят на участках предшествующей остеорезорбции остеокластами и характеризуются слабой, плохоорганизованной структурой кости, способствующей возникновению переломов различных костных элементов скелета (Preston D.M., et al., 2002; Rabbani S.A., et al., 1999). В иммуногистохимических исследованиях экспрессии ПТГрП в биоптатах ткани костных метастазов у больных РПЖ, не получавших лечения, у становлена разная степень выраженности продукции ПТГрП в разных образцах, не связанная со степенью дифференциации клеток опухоли (Bryden A.A, et al., 2002).
Под влиянием факторов костной микросреды, клетки скелетных метастазов рака молочной железы продуцируют ПТГрП больше, чем клетки первичной опухоли (Akhtari M., et al., 2008). TGF-β, поступающий из локусов резорбции кости, регулирует производство ПТГрП через сигнальный путь с участием фактора транскрипции Gli2 (Akhtari M., et al., 2008; Johnson R.W., et al., 2011). В свою очередь, ПТГрП увеличивает выработку рецептора активатора ядерного фактора-kB лиганда и снижает производство остеопротегерина, увеличивая количество остеокластов и их активность (Akhtari M., et al., 2008). Это формирует порочный круг взаимозависимости между продукцией ПТГрП и резорбцией костной ткани, способствуя активации остеолиза. Кроме того CaSR-сигнализация (при участии кальций-чувствительного рецептора) в клетках рака молочной железы стимулирует выработку ПТГрП и может оказывать влияние синергично с эффектами TGF-бета (Mamillapalli R., et al., 2008; Sanders J.L., et al., 2000).
Установлено, что ПТГрП модулирует адгезию, миграцию и инвазию не только клеток костных метастазов но и может быть важным фактором развития первичных опухолей костной ткании, в частности, гигантоклеточной опухоли кости (Mak I.W., Turcotte R.E., 2013). Показано, что С-концевой домен ПТГрП (107-139) и его фрагмент ПТГрП (107-111) человека ингибировали пролиферацию остеобластов линии UMR-106 остеосаркомы крыс. Обнаружено, что антипролиферативное действие этих С-концевых пептидов ПТГрП может быть независимым от цАМФ и опосредованно протеинкиназой-C (Valín A., et al., 1997).
Установлено, что в клетках РПЖ и в ткани костных метастазов имеет место усиленная экспрессия конституитивно активированной рецепторной тирозинкиназы DDR2, участвующей в регуляции клеточной дифференцировки, ремоделировании внеклеточного матрикса, клеточной миграции и дифференциации, что способствует активации инвазии опухолевых клеток. Сверхэкспрессия DDR2 в клетках приводит к заметному ускорению дифференциации остеокластов и активации резорбции костной ткани, в то время как нокдаун DDR2 вызывал противоположные эффекты. Доказано, что DDR2 способствует остеолитическому метастазированию регулируя экспрессию, секрецию и активацию промотора ПТГрП посредством модулирования фактора транскрипции RUNX2. Таким образом, DDR2 участвует в TGF-бе-
та-опосредованной активации остеокластов и резорбции костной ткани и играет существенную роль в костном метастазировании рака простаты (Yan Z., et al., 2014).
Установлено, что активация универсального фактора транскрипции NF-kB «каппа-би», контролирующего апоптоз и клеточный цикл, коррелирует с прогрессированием рака простаты и способствует метастазированию опухоли, влияя на миграцию клеток опухоли и ангиогенез. Инактивация NF-kB сигнализации в клетках опухоли приводит к повышению экспрессии ПТГрП и RANKL и способствует пролиферации костных метастазов, включая как остеобластные, так и остеокластные процессы (Jin R., et al., 2013).
ПТГрП стимулирует остеокластопосредованную резорбцию кости. Матричные металлопротеиназы (ММР-2,-3,-7,-9) могут осуществлять процессинг ПТГрП (1-36) на отдельные пептиды (ПТГрП (1-17); ПТГрП (18-26) и ПТГрП (27-36)). ММР-индуцированные пептиды обладают разными биологическими свойствами и влиянием на остеобласты и остеокласты. Установлено выраженное влияние ПТГрП (1-17) и ПТГрП (1-36) на стимулирование дифференцировки остеобластов in vitro. Однако in vivo ПТГрП (1-36) индуцировал четкий остеолитический эффект, который не наблюдался у ПТГрП (1-17). Эти данные позволили полагать, что матричные металлопротеиназы играют существенную роль в регуляции остеолитически-остеогенной реакции при метастатическом раке. (Frieling J.S., et al., 2015).
Продуцируемый первичными опухолями ПТГрП, функционируя как эндокринный фактор может участвовать в регуляции костной микросреды в различных структурах скелета и таким образом может поддержать формирование «преметастатической ниши», в которой существуют условия, необходимые для развития микрометастазов (Kaplan R.N., et al., 2006). Так ПТГрП продуцируемый опухолью может индуцировать экспрессию CCL2 в остеобластах, вызывая хемотаксис макрофагов и активацию остеокластогенеза, способствуя модуляции костной микросреды благоприятной для метастазирования, что будет способствовать росту и прогрессии опухолей (Li X., et al., 2009). Кроме ПТГрП опухоли секретируют и другие факторы, которые также могут дистантно модулировать костную микросреду. Это свидетельствует о потенциальной возможности формирования локусов костной ткани с микросредой благоприятствующей для последующей колонизации опухолевыми клетками и развития метастазов. Так, фермент гепараназа, вырабатываемый клетками рака молочной железы, расщепляет гепаран для производства синдекана-1, который поступая из первичной опухоли в кости, стимулирует остеокластогенез, что способствует остеолизу и росту метастазов (Kelly T., et al., 2005; Kelly T., et al., 2010). Другие факторы, такие как остеопонтин и матричные металлопротеиназы, также могут играть определенную роль в содействии росту опухоли и ее скелетному метастазированию (Anborgh P.H., et al., 2010; Lynch C.C., et al., 2005).
С остеотропными эффектами ПТГрП связано явление «заторможенности» опухолевого процесса. Заторможенность опухолевой клетки является одной из самых больших проблем в скелетном метастазировании которая связана с рецидивированием опухоли (Gao C.L., et al., 1999). Метастазирование очень неэффективный процесс, в котором менее чем 0,01 % попадающих в циркуляторное русло опухолевых клеток формируют метастатические очаги (Fidler I.J., 2003; Langley R.R., Fidler I.J., 2011).
Скелет представляет собой очень сложную среду с постоянным ремоделированием костной ткани, участием в кроветворении и очень богатой внутренней средой содержащей большой пул факторов роста и минеральных компонентов. Это объясняет тот факт, что кости являются одним из наиболее общих участков метастазирования различных видов опухолей. Считается, что распространение опухоли является процессом, который происходит уже на ранних этапах онкогенеза, но при этом большинство клеток, попавших в циркуляторное русло, не могут достигнуть подходящей ниши («почвы») для ее колонизации (Fidler I.J., 2003). Утверждается, что, когда опухолевым клеткам удается преодолеть эту проблему и найти далекий орган, чтобы колонизировать, они могут оставаться в состоянии покоя («клеточной дремоты») в течение многих лет (Nguyen D.X., et al., 2009). Это может быть причиной того, что у пациентов с солидными опухолями, которые были полностью удалены, десятилетия спустя развиваются костные метастазы, даже если первичные опухоли больше не существуют. Другая проблема состоит в том, что обнаружение таких дремлющих клеток представляет трудности. Большинство скелетных метастазов диагностируется только тогда, когда опухоли могут быть визуализированы и часто это становится возможным на поздних стадиях. Клеточная неподвижность при клеточной дремоте также является большой проблемой, так как большинство противораковых терапевтических стратегий нацелены на высоко пролиферативные клетки. Обнаружение циркулирующих опухолевых клеток в костном мозге показало, что кости также могут быть потенциальной средой-убежищем (Gao C.L., et al., 1999), где опухолевые клетки остаются в состоянии покоя, пока они не будут передислоцированы в другие сайты или даже вернутся к месту своего происхождения. ПТГрП является интересным кандидатом для инициации клеточной дремоты поскольку действует не только интракринно и аутокринно для модуляции экспрессии генов и клеточных реакций в опухолях, но и паракринно участвует в модуляции костной микросреды. Действие ПТГрП в регуляции клеточного цикла и экспрессии интегринов, может быть благоприятным для клеток опухоли, чтобы прикрепиться к кости и приобрести состояние покоя, до того момента, когда они будут активированы до процесса пролиферации и образования обнаруживаемых метастазов.