
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Функциональные и метаболические эффекты симпато-адреналовой системы и стресс
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
3. Стресс и симпато-адреналовая система
Многочисленными исследованиями установлено, что роль пускового фактора во многих реакциях организма, в ответ на действие разнообразных агентов, играют гормоны мозгового вещества надпочечников, выполняющие одновременно роль медиаторов симпато-адреналовой системы. Экстренное выделение катехоламинов при действии внешних стимулов есть первое проявление стресса.
Согласно представлениям И.П. Павлова, реакция организма на чрезвычайное разражение и возникающие при этом повреждения органов, являются результатом нарушения трофики, вызываемых чрезмерной нервной импульсацией. На основании многочисленных исследований Л.А. Орбели построил теорию об адаптационно-трофической функции симпатической нервной системы. «С одной стороны, она (симпатическая нервная система) изменяет функциональные свойства, адаптация, с другой – вызывает существенные химические, физико-химические и физические сдвиги (трофики)» – Л.А. Орбели (1962).
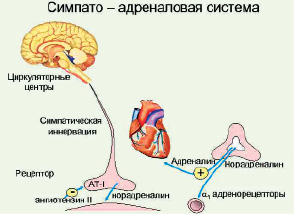
Рис. 8. Симпато-адреналовая система
Целым рядом исследований показано, что возбуждение симпато-адреналовой системы, сопровождаемое мобилизацией катехоламинов, является одной из ранних реакций организма на лучевое воздействие и свидетельствует о пусковой роли гормонов мозгового вещества в реакциях адаптации (В.С. Даниленко и др., 1970, Г.М. Мусагалиева и др., 1988).
Известно (А.М. Бару, 1968,), что увеличение или уменьшение коэффициента А/НА отражает степень активности периферического, либо центрального отдела симпато-адреналовой системы (САС). Установлено, что стресс может привести к нарушениям механизмов адаптационных реакций, к истощению медиаторного звена симпато-адреналовой системы.
Наблюдаемая при стрессе активация симпато-адреналовой системы носит компенсаторный характер и происходит за счет гуморального звена. Повышенная экскреция катехоламинов при стрессе также указывает на значительную активацию симпато-адреналовой системы.
Активация симпато-адреналовой системы при хирургическом стрессе вызывает нарушения гемодинамики, особенно эти нарушения выражены у больных с облитерирующими заболеваниями сосудов, у которых отмечаются снижение сердечного и ударного индексов, повышение общего периферического сопротивления сосудов.
Вместе с тем, активация симпато-адреналовой системы с относительным преобладанием гормонального звена в ближайшем послеоперационном периоде рассматривается как одно из неблагоприятных проявлений постишемического периода.
Длительно существующие высокие концентрации катехоламинов в крови отрицательно влияют на микроструктуру миокарда, вызывают аритмию, резко увеличивают содержание циклических нуклеотидов в клетках сердечной мышцы (Podzweit I. et al., 1981). Ежедневное, в течение 6 недель введение адреналина в дозе 100 мкг/кг веса вызывает изменения обмена веществ и функции органов, характерные для состояния длительной физической тренировки.
Установлено, что токсические дозы катехоламинов могут способствовать развитию аритмий (П.Ф. Литвицкий, 1979), уменьшению эффективности механической работы, повышению потребления кислорода, гипоксемии и развитию феномена «кислородной утечки» (М.Е. Райскина и др., 1963, И.В. Голубева, 1972, Opie L.H. et al., 1979).
Это действие катехоламинов сопровождается сменой прессорных влияний на депрессорные и вызвана стимуляцией бета2-адренорецепторов и может быть предотвращена введением кальция и бета-адреноблокадой (Opie L.H. et al., 1979). Введение токсических доз катехоламинов приводит к некротическим изменениям, воспалению и фибринозному перерождению миокарда (Haft J.I., 1973), нарушению структуры митохондрий (К.С. Митин и др., 1975).
Защитным действием к катехоламиновым некрозам миокарда обладают бета-адренолокаторы (В.В. Малышев и др., 1986 Kulig A. et al., 1973) и антиоксиданты типа витамина Е и этанол. Положительный эффект бета-адреноблокаторов наблюдается и при остром инфаркте миокарда (Edoute Y et al., 1981) и при нейрогенных поражениях миокарда, вызванных трехчасовой электростимуляцией дуги аорты (И.С. Заводская и др., 1977).
Большой цикл исследований по проблеме влияния стресса на кровообращение человека провели P. Obrist (1985) и Е.В. Белова (1987). Согласно этим работам, при стрессе характерно увеличение ЧСС, повышение минутного обьёма кровобращения (МОК) и систолического АД, при отсутствии повышения общего периферического сопротивления сосудов (ОПС), а при корректурной пробе – увеличение ОПС и диастолического АД, без повышения МОК.
В других работах (Б.М. Федоров, 1991) отмечено, что во время стрессового воздействия при напряженной умственной работе показатели кровообращения в различных случаях изменяются не однотипно. В ряде наблюдений вначале отмечается снижение ОПС сосудов и увеличение МОК. По мере нарастания стрессорной реакции характер изменений системной гемодинамики существенно изменялся. При этом снижение тонуса сосудов большого круга кровообращения сменяется его повышением. Соответственно более резко повышается АД и менее значительно повышается или даже снижается МОК.
В стрессорных ситуациях изменяется сердечная деятельность, состояние артериальных и венозных сосудов, микрогемоциркуляция. Учащение сердечных сокращений лишь до определенного предела отражает выраженность стрессорной реакции.
Нарушения кровообращения четко коррелируют с динамикой стрессорных реакций. Влияние стрессов на кровообращение на микроциркуляторном уровне выражается в констрикции артериол, появлением агрегатов эритроцитов, нарушением сосудистой проницаемости, замедлением кровотока в венах, а затем в артериолах, возникновением стазов.
Установлено, что изменения активности симпатической нервной системы, общего периферического сопротивления сосудов и среднего артериального давления в ходе хирургического стресса имеют однонаправленный характер (Т.С. Тапбергенов, 1992).
При психоэмоциональном стрессе отмечено изменение реологических свойств крови, в частности, увеличение ее вязкости и проницаемости стенок венулярных сосудов.
Как показано исследованиями Т.С. Тапбергенова (1992), при хирургическом стрессе степень выраженности изменений показателей вегетативной регуляции и центральной гемодинамики зависят от исходного состояния каждого из них и этапа оперативного вмешательства. При исходно высоком тонусе симпатического отдела вегетативной нервной системы его влияние на среднее артериальное давление и тонус сосудов компенсирует, ожидаемое в начале операции, угнетение сердечно-сосудистой системы, а исходно низкая симпатическая активность вегетативной регуляции усугубляет гемодинамические нарушения в ходе хирургического вмешательства.
В происхождении различных вариантов изменений гемодинамики в стрессорных и экстремальных ситуациях существенное значение имеют изменения венозного возврата крови к сердцу. Так развитие прессорной реакции, вызванной введением катехоламинов, в начальном периоде связано с изменениями тонуса артерий и соответственно повышением общего периферического сопротивления.
При дальнейшем развитии прессорной реакции, вызванной катехоламинами, характерно повышение роли венозного возврата в формировании величины сердечного выброса. Роль этих изменений в поддержании высоких показателей АД становится весьма существенной, составляя до 50 % вклада в реализацию эффекта гипертензии (Б.Я. Зонис, 1986). Давление в венах, состояние окружающих их тканей, в частности скелетных мышц, и особенно симпатическая стимуляция венозного тонуса, чувствительность альфа-адренорецепторов, обеспечивающих констрикторные эффекты – все это отражается на изменении просвета сосудов, емкости венозного русла и возврате крови к сердцу.
Показана возможность в условиях патологии значительного увеличения объёма вен и задержки в них крови при сочетании повышенного давления в растянутых венах с адренергической стимуляцией венозных «сфинктеров», расположенных в области венозных клапанов. При стрессорных воздействиях возникновение коллаптоидных состояний может быть следствием резкого снижения возврата венозной крови к сердцу. Повышение тонуса венозных сосудов и увеличение венозного возврата рассматривается как существенный фактор в патогенезе гипертонии.
Анализ результатов реакции торможения миграции лимфоцитов (РТМЛ) с митогеном конкавалином А (Соn A) в присутствии различных концентраций норадреналина, позволяющей оценить чувствительность адренорецепторов (В.Р. Вебер, 1992), показал, что на разных этапах хирургического стресса имеет место снижение индекса чувствительности адренорецепторов лимфоцитов к норадреналину (табл. 1).
Таблица 1
Индекс торможения миграции лимфоцитов при хирургическом стрессе (на 100 клеток, М ± m)
|
Показатель |
До операции |
В начале операции |
Травматический этап операции |
Конец операции |
Ранний послеоперационный период |
|
Индекс чувствительности |
9,25 ± 0,1 |
9,3 ± 0,2 |
9,8 ± 0,3* |
11,1 ± 0,3* |
10,03 ± 0,27* |
Примечание: * – p < 0,01.
При хирургическом стрессе в интраоперационный период увеличивается экскреция катехоламинов с мочой, а в послеоперационный период начинает снижаться (табл. 2).
Таблица 2
Суточная экскреция катехоламинов в моче при хирургическом стрессе
|
Показатель |
Периоды хирургического стресса |
||
|
До операции |
Интраоперационный этап |
Послеоперационный период |
|
|
Адреналин |
6,85 ± 0,85 |
17,85 ± 2,25* |
9,68 ± 1,76** |
|
Норадреналин |
6,61 ± 0,76 |
13,67 ± 3,3* |
8,76 ± 2,21** |
|
АД/НА |
1,04 ± 0,02 |
1,30 ± 0,04* |
1,10 ± 0,05** |
Примечание: (*), (**) достоверные различия (p < 0,01) по сравнению с предыдущим периодом.
В раннем послеоперационном периоде истощение периферического звена симпатической нервной системы приводит к тому, что высокая симпатическая активность начинает осуществляться на центральном уровне и носит нейрогенный характер при одновременном повышении автономизации контура вегетативной регуляции. Это выражается в повышении индекса напряжения, снижении соотношения АД/НА (адреналин / норадреналин) в моче (табл. 2).
Увеличение экскреции с мочой адреналина, норадреналина, ДОФА, дофамина и ванилилминдальной кислоты происходит и при остром инфаркте миокарда (Kedrowa S., et al., 1973).
Характер изменений уровней вегетативной регуляции и их влияние на состояние центральной гемодинамики зависит как от исходного состояния вегетативной и сердечно-сосудистой системы, так и от этапа хирургического вмешательства. Высокая исходная парасимпатическая активность (выраженные вагусные реакции) могут стать неблагоприятными факторами и прогностическими признаками для проведения анестезии и оперативного вмешательства (Т.С. Тапбергенов, 1992).
Таким образом, хирургическое вмешательство является типичным стрессорным фактором и, не смотря на достаточную анестезиологическую защиту, в организме происходят существенные изменения регуляторных влияний ВНС на центральную гемодинамику, тонус периферических сосудов и работу сердца. При этом имеет место изменение функции адренорецепторного аппарата, а соотношение симпатических и парасимпатических регуляторных механизмов смещается в сторону стимуляции симпатических влияний.
Не вызывает сомнений и значение нервного фактора в происхождении миокардодистрофий, инфаркта миокарда (И.К. Шхвацабая, 1962, 1975), и другий заболеваний сердца, желудка, печени, легких (И.С. Заводская, Е.В. Морева, 1981).
В патогенезе этих постстрессорных нейрогенных состояний существенное значение принадлежит изменениям уровня и метаболизма катехоламинов (Selye H., 1960, Шхвацабая И.К. и др., 1962).
Об истощении запасов тканевых катехоламинов при стрессорных поражениях миокарда свидетельствуют данные об усилении секреции катехоламинов в кровь (Abrahamson T. et al., 1981). Нейроанелгезирующие средства типа фентанил и дроперидол снижают уровень катехоламинов в крови при крупноочаговом инфаркте миокарда (Т.И. Лукичева и др., 1974).
В эксперименте на ишемизированном сердце показано усиление высвобождения катехоламинов из синаптических нервных окончаний (Hough F.S.1975), ослабление механизмов обратного захвата, снижение уровня протеидизированного норадреналина (М.П. Барц и др., 1979).
Люминисцентный анализ адренергических нервных структур сердца, поврежденных стрессированием и ишемией, показал (И.К. Григалюнене, 1976), что в первые часы и сутки развития инфаркта миокарда наблюдаются дистрофические изменения адренергических нервных структур и полная потеря запасов в них катехоламинов.
Эти данные свидетельствуют о нарушении симпатической импульсации не только в зоне инфаркта, но и вблизи ее (А.С. Виткус и др., 1974). В этой связи, вполне оправдано применение средств усиливающих обратный захват катехоламинов адренергическим нейроном, так и использование предшественников катехоламинов, таких как ДОФА (С.В. Аничков и др., 1974, И.С. Заводская и др., 1977), также факторов, стимулирующих тканевое дыхание и повышающих активность дыхательных ферментов, коронаролитиков, аденозина и противо ишемических адреномодуляторов (Matier W. еt al., 1980).
В проведенных нами экспериментах была использована модель нейрогенного стресса, вызываемая нанесением чрезвычайного разражения на рефлексогенную зону дуги аорты импульсным током в течение 3 часов (З.И. Веденеева, 1964). При этом виде стресса наряду с диффузными поражениями миокарда, имеет место дисбаланс и истощение содержания катехоламинов в тканях (И.С. Заводская и др., 1977, 1981). На ЭКГ отмечается изменение вольтажа зубцов P, R, S и укорочение интервала R-R, снижение вольтажа зубца Т, смещение интервала S-T вниз к изоэлектрической линии. В ряде случаев имело место сглаживание, и даже исчезновение зубца S. Все эти изменения указывали на дистрофические и гипоксические нарушения в миокарде вызванные нейрогенным стрессом.
Наиболее общей закономерностью гипоксии наблюдаемой при стрессе является переключение с аэробного пути обмена углеводов на анаэробный, приводящий к накоплению молочной кислоты и сдвигу рН в кислую сторону. При этом усиливается утилизация миокардом жирных кислот и катехоламинов (Gvozdjak J., 1973). Однако, повышение уровня свободных жирных кислот, может привести к снижению сократительной способности миокарда и желудочковой аритмии (Oliver M.F., 1972).
Наибольшие нарушения при стрессорных поражениях миокарда происходят в митохондриях, изменения в которых связаны с активацией симпато-адреналовой системы (В.В. Долгов, 1975). Через час после экспериментального инфаркта миокарда митохондрии набухают, уменьшается в них число крист, снижается скорость окисления оксибутирата, сукцината, аскорбата. При этом имеет место большее снижение активности сукцинатоксидазной системы по сравнению с НАФН-оксидазной системой инфарктной и интактной зон (А.С. Тойлейкис и др., 1973). При ишемии нарушается процесс окислительного фосфорилирования (К.Л. Гудонавичене и др., 1977), снижается уровень АТФ, увеличивается концентрация АДФ, АМФ, аденозина, инозина и гипоксантина (Degenring F., et al., 1975).
Нейрогенные поражения миокарда, вызванные трехчасовой электростимуляцией дуги аорты, приводят к разобщению окислительного фосфорилирования, к снижению запасов АТФ и креатинфосфата, к активации глюкозо-6-фосфатдегидрогеназы.
Аналогичные изменения в митохондриях и активация ключевого фермента пентозного цикла имеют место при норадреналиновом повреждении миокарда. Введение токсических доз катехоламинов приводит как при любом другом нейрогенном стрессе, к истощению запасов тканевых гормонов-медиаторов симпато-адреналовой системы в миокарде и печени. Эти изменения сходны с теми, которые развиваются при дистрофиях, вызванных денервированием ткани (Н.А. Новикова, 1976), что подтверждает важную роль медиаторов симпатического отдела нервной системы в обеспечении адаптационных механизмов к стрессовым нагрузкам через регуляцию активности митохондриальных ферментов, т. е. через биоэнергетику клетки.
Изучение захвата Н3-норадреналина срезами тканей интактных животных и подвергнутых нейрогенному стрессу, вызванного трехчасовой электростимуляцией дуги аорты позволило обнаружить резкое снижение захвата норадреналина срезами предсердий и печени при нейрогенном стрессе (табл. 3).
Таблица 3
Влияние нейрогенного стресса и введения токсических доз норадреналина на захват Н3-норадреналина срезами предсердий, миокарда и печени
|
Группа животных |
Предсердие |
Миокард |
Печень |
|
Интактные животные |
69,61 ± 2,65 |
26,90 ± 1,12 |
10,02 ± 0,39 |
|
Норадреналин 0,5 мг/100 г |
32,53 ± 3,56* |
15,39 ± 0,73* |
9,92 ± 0,40 |
|
Нейрогенный стресс |
57,20 ± 3,08* |
25,38 ± 0,51 |
8,67 ± 0,41* |
Примечание: * – p < 0,01.
Обнаружено снижение захвата Н3-норадреналина срезами предсердий и миокарда при введении животным токсических доз норадреналина (0,5 мг/100 г) за 30 минут до исследования (табл. 3).
Эти данные свидетельствуют о том, что стресс, вызванный трехчасовой электростимуляцией дуги аорты по своему патогенетическому действию сходен с действием токсических доз катехоламинов, вызывающих некроз миокарда. И в основе стрессорных поражениях миокарда лежит резкое снижение захвата катехоламинов. Это вначале приводит к длительной адренергической импульсации, вызывающей метаболические сдвиги в энергетическом обмене и в обмене самих гормонов-медиаторов. Всё это, в конце – концов, приводит к истощению их содержания в ткани, а значит к нарушению трофической функции симпатической нервной системы.
Истощение запасов тканевых катехоламинов при стрессе связано также и с нарушением механизмов обратного захвата их адренергическим нейроном, поскольку при блокаде бета-адренорецепторов обзиданом обратный захват норадреналина при нейрогенном стессе и при гипернорадреналинемии еще больше снижается (табл. 4).
Таблица 4
Влияние нейрогенного стресса и введения токсических доз норадреналина на захват Н3-норадреналина на фоне блокады бета-адренорецепторов обзиданом
|
Группа животных |
Предсердие |
Миокард |
Печень |
|
Интактные животные |
69,61 ± 2,65 |
26,90 ± 1,12 |
10,02 ± 0,39 |
|
Норадреналин + бета адреноблокада |
11,93 ± 1,08* |
9,78 ± 0,45* |
8,4 ± 0,26* |
|
Нейрогенный стресс + бета адреноблокада |
11,56 ± 0,69* |
10,24 ± 0,43* |
9,04 ± 0,48* |
Примечание: * – p < 0,01.
Известно (М.Н. Манухин и др., 1975), что блокада бета-адренорецепторов при неповрежденном механизме нейронального захвата должна сопровождаться усилением захвата медиатора, то всякое воздействие, при котором этого не происходит, связано с нарушением захвата катехоламинов, что и имеет место, как показано нашими исследованиями, и при стрессе.
Подтверждением снижения симпатической импульсации при стрессе служат данные по определению уровня 3`5`АМФ и активности аденилатциклазы (табл. 5).
Таблица 5
Влияине нейрогенного стресса и последующей обработки клеток миокарда катехоламинами (0,01 мкмоль) на уровень 3`5`АМФ и активность аденилатциклазы (в пкмоль 3`5`АМФ на гр. белка)
|
Показатель |
Интактные животные |
Нейрогенный стресс |
|||
|
НА |
АД |
адреноксил |
|||
|
293,0 ± 49,8 |
3,17 ± 1,5* |
41,4 ± 15,2** |
46,4 ± 6,6** |
43,7 ± 16,5** |
|
|
Аденилатциклаза |
1200,0 ± 56,1 |
1037,7 ± 24,03* |
1555,5 ± 43,9** |
1319,8 ± 13,95** |
1552,1 ± 10,15** |
Примечание: * (р < 0,01) – для сравнения с нтактными животными;
** (р < 0,01) – для сравнения с нейрогенным стрессом.
Нейрогенный стресс, вызванный трехчасовой электростимуляцией дуги аорты приводит к резкому снижению базального уровня 3`5`АМФ и к снижению активности аденилатциклазы. Но предварительная инкубация гомогенатов миокарда с норадреналином, адреналином и адреноксилом, приводит к повышению уровня 3`5`АМФ и к некоторой активации аденилатциклазы в сердце (табл. 5).
Эти данные свидетельствуют о том, что реализация симпатического сигнала в клетку при нейрогенном стрессе нарушается до аденилатциклазного механизма. Нарушение идет на уровне адренорецепции и на уровне захвата медиатора.
При нейрогенном стрессе, вызванным трехчасовой электростимуляцией дуги аорты, в митохондриях сердца повышается активность моноаминоксидазы типа А и В-типа, в митохондриях почек – В-типа. В митохондриях мозга через три часа после стрессорного воздействия активность МАО В-типа снижается (табл. 6).
Таблица 6
Активность МАО через 3 часа после нейрогенного стресса вызванного электростимуляцией дуги аорты
|
МАО |
Сердце |
Мозг |
Почки |
|||
|
контроль |
3 часа |
контроль |
3 часа |
контроль |
3 часа |
|
|
А тип |
43,02 ± 7,01 |
62,18 ± 3,97* |
98,65 ± 11,26 |
99,44 ± 12,71 |
32,47 ± 4,63 |
39,41 ± 3,37 |
|
В тип |
109,28 ± 13,33 |
222,46 ± 11,12* |
173,98 ± 16,71 |
119,21 ± 9,03* |
51,08 ± 13,33 |
61,36 ± 3,02* |
Примечание: * – p < 0,01 по сравнении с контролем.
Эти данные свидетельствуют о том, что наиболее подвержены действию нейрогенного стресса клетки сердца и почек, где имеет место интенсивное моноаминоксидазное разрушение катехоламинов, что также является одной из причин ослабления адренергической импульсации в этих органах.
Таким образом, установлено, что при нейрогенном стрессе происходит резкое нарушение функции симпато-адреналовой системы за счет снижения обратного захвата катехоламинов адренергическим нейроном, что вначале проявляется длительной адренергической импульсацией, а затем истощением содержания катехоламинов в ткани.
Нейрогенный стресс сопровождатся резким снижением базального уровня 3`5`АМФ и сниженим активности аденилатциклазы. Таким образом, реализация симпатического сигнала в клетку при нейрогенном стрессе нарушается до аденилатциклазного механизма, т. е. на уровне адренорецепции и на уровне захвата медиатора. Кроме того, за счет ускорения моноаминоксидазного пути разрушения катехоламинов, происходит снижение адренергической импульсации и в первую очередь, в сердечно-сосудистой системе.