
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Функциональные и метаболические эффекты симпато-адреналовой системы и стресс
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
9.3. Хиноидное окисление катехоламинов
Исследования по изучению хиноидного окисления катехоламинов и биологического значения образующихся продуктов послужили основой для создания А.М. Утевским концепции о функциональном значении обмена регуляторов обмена (А.М. Утевский, 1954, 1959, 1977). При хиноидном окислении катехоламинов образуются соответствующие деметилированные хиноны, образуются продукты индоловой и оксииндоловой структуры и возникают три редокс-системы:
адреналин ↔ дегидроадреналин
адренохром ↔ лейкоадренохром
оксоадренохром ↔ лейкооксоадренохром
Как было показано исследованиями В.О. Осинской (1955, 1957, 1965, 1969) продукты хиноидного окисления (лабильные и стабильные) лучше выявляются в тех тканях, где имеет место низкая активность КОМТ и МАО, например, в скелетных мышцах.
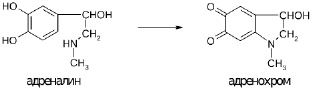
Рис. 14. Адренохром
Хиноидное окисление катехоламинов может катализироваться многими ферментами (цитохром с-оксидаза, катехолоксидаза, церулоплазмин). Окисление адреналина в адренохром ускоряет супероксид анион – радиакла 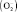 , который может образоваться при диссоциации пероксид-радикала (О2Н–), образующегося при восстановлении ФМНН кислородом или при ксантиноксидазной реакции.
, который может образоваться при диссоциации пероксид-радикала (О2Н–), образующегося при восстановлении ФМНН кислородом или при ксантиноксидазной реакции.
Супероксиддисмутаза, предотвращающая образование супероксидного аниона, замедляет хиноидное окисление катехоламинов (Misra H.P. et al., 1972). Восстановленный глутатион, цистеин, аскорбиновая кислота в присутствии ЭДТА, ингибируют хиноидное окисление адреналина, но слабее чем супероксиддисмутаза (О.С. Брусов и др., 1976). Окислению норадреналина в безкислородных условиях способствует редуктон-комплекс: аденин-Сu++ (Murakami H. et al., 1975).
Аминозин, как донатор электронов, в присутствии пероксидазы ускоряет окисление катехоламинов до соответствующих аминохромов (Løvstad R.A., 1979) и образует с адренохромом комплекс более стабильный, чем комплекс ацетилхолин-адренохром (Galzigna L., 1972).
Первое указание на наличие специфического фермента окисляющего адреналин в адренохpом было осуществлено J. Axelrod (1964). Им было обнаружена ферментативная циклизация адреналина в секрете слюнных желез кошки и выделен фермент неустойчивый к температурным воздействиям. Цианид, диэтилдитиокарбомат, аскорбиновая кислота, глютатион подавляют активность пирокатехинаминоциклазы.
Аналогичный фермент был обнаружен в сыворотке крови больных шизофренией (Altshule M., Novak U., 1979), окисляющий норадреналин в норадренохром в присутствии ацетилхолина, перекиси водорода и цианида. В сравнении со здоровыми, у больных шизофренией активность пирокатехинаминоциклазы увеличена в два раза.
Увеличение активности этого фермента в крови имеет место у больных с маниакально-депрессивным психозом. Седуксен (диазепам), препараты фенотиазинового ряда снижают активность этого фермента (Galzigna L. et al., 1973).
Высокий уровень адренохрома в крови больных шизофренией и увеличение активности пирокатехинаминоциклазы подкрепляет адренохромную гипотезу шизофрении возникшей на способности адренохрома и адренолютинов вызвать негативизм, ступор, кататанию. Предполагают, что психогенным действием обладает комплекс ацетилхолин-адренохром, оказывающий ингибирующее действие на ацетилхолинэстеразу и активирующий моноаминоксидазу (Galzigna L. et al., 1973).
Установлено, что при охлаждении адаптированных к холоду, животных содержание хиноидных продуктов увеличивается в скелетных мышцах и в митохондриях печени. Увеличение экскреции адренохрома и адренолютина наблюдается при повышении температуры тела до 40 °С (В.О. Осинская, 1969).
При тиреоидиновом токсикозе и при тяжелом миокардите увеличивается уровень хиноидных продуктов в сердце и печени (В.О. Осинская, 1964).
Адренохром и моносемикарбозон адренохрома (адреноксил) обладают антигеморрагическим и гемостатическим (Avitablle G., 1962) и гемолитическим действием (Valerri C. et al., 1972).
Как было показано нашими исследованиями, адреноксил в дозе 0,2 мг/100 г вызывает лишь легкое повышение артериального давления и, в отличие от норадреналина, незначительное увеличение число сердечных сокращений, нестабильное изменение интервала R–R, P–Q, которые быстро нормализуются (С.О. Тапбергенов, 1985).
В отличие от адреналина и норадреналина, являющиеся агрегирующими тромбоциты факторами, адренохром и адреноксил задерживают время начала агрегации и даже могут в ряде случаев вызвать дезагрегацию тромбоцитов.
Адренохром через 30 минут после введения увеличивает содержание гликогена в печени и мышцах, через 60 минут в сердечной и скелетной мышцах и не влиял на уровень глюкозы в крови, содержание молочной кислоты в печени, сердце и мышцах (Г.А. Ивашкина, 1973).
Адреноксил снижает уровень КоА и содержание неэстерифицированных жирных кислот в сердце, печени, мозге и скелетных мышцах (А.К. Менисов, 1972).
Адренохром и норадренохром резко подавляют гликолиз в мозге (Hochstein P. et al., 1960). В изолированных клетках бурого жира адренохром стимулирует апотомический путь окисления глюкозы, приводит к увеличению уровня цАМФ, ингибировал фосфодиэстеразу (Wieser P., Fain J., 1973).
Как было установлено нами (С.О. Тапбергенов, В. Коптелов, 1982), адреноксил независимо от адренорецепторов повышает активность аденилатциклазы и уровень цАМФ в сердце (табл. 17).
В отличие от норадреналина, адреноксил усиливает захват Н3-норадреналина срезами предсердий, миокарда и печени интактных животных (табл. 18), что указывает на функциональную значимость продуктов хиноидного обмена катехоламинов в регуляции содержания медиатора в синаптической щели, следовательно, регуляции адренергической реакции.
Таблица 17
Влияние катехоламинов (10–5 М) на уровень 3`5`АМФ и активность аденилатциклазы на фоне бета-адреноблокады
|
Показатель |
Интактные животные |
Бета-адреноблокада |
|||
|
НА |
АД |
адреноксил |
|||
|
293,0 ± 49,8 |
68,4 ± 6,69* |
74,2 ± 5,10** |
94,00 ± 12,27** |
90,4 ± 16,38** |
|
|
Аденилатциклаза |
1200,0 ± 56,1 |
1026,4 ± 30,39* |
1033, ± 93,6 |
834,8 ± 21,8 |
2146,2 ± 29,5** |
Примечание: * – (р < 0,05) для сравнения с интактными животными;
** – (р < 0,05) для сравнения с бета-адреноблокадой.
Предполагали, что продукты хиноидного окисления катехоламинов могут повышать потребление кислорода тканями и повышать скорость окисления некоторых субстратов цикла Кребса (Н.С. Леванцова, 1939). Однако рядом исследований показано, что в опытах in vitro они снижают потребление кислорода тканью мозга и сердца (В.А. Коржов и др., 1959, М.Ю. Гайсинская и др., 1962), могут разобщать окислительное фосфорилирование, ингибировать АТФ-азу митохондрий (В.Е. Судовцев, 1969).
Таблица 18
Влияние катехоламинов на захват Н3-норадреналина срезами предсердий, миокарда и печени интактных животных
|
Группа животных |
Предсердия |
Миокард |
Печень |
|
Контроль |
69,63 ± 2,65 |
26,90 ± 1,12 |
10,02 ± 0,30 |
|
Норадреналин (0,5 мг/100 гр) |
32,53 ± 3,56* |
15,39 ± 0,73* |
9,92 ± 0,40 |
|
Адреноксил (0,2 мг/100 гр) |
90,59 ± 5,31* |
30,54 ± 1,22* |
13,29 ± 0,59* |
Примечание: * – (р < 0,05) для сравнения с интактными животными.
Таким образом, факторы, влияющие на метаболизм катехоламинов, изменяют направленность и специфичность физиологических и метаболических эффектов нативных молекул гормонов-медиаторов симпато-адреналовой системы.