
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.1. Основные понятия классической химии (повторите определение химии, приведённое во введении)
Одними из основополагающих понятий классической химии являются: атом, элемент, молекула, масса, молекулярная масса, количество вещества, моль, число Авогадро, постоянная Авогадро, молярная масса, степень окисления атома, валентность, химическая связь, ковалентность, эквивалент. Хотя значения многих из этих терминов рассматривались на школьных занятиях по химии, тем не менее, приведённые ниже определения рекомендуется использовать в качестве справочного материала на протяжении изучения всего настоящего курса.
Первые два понятия – атом и элемент настолько взаимосвязаны, что даже определяются друг через друга.
Атом – это мельчайшая нейтральная частица химического элемента, состоящая из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Химический элемент – это простое вещество, состоящее из атомов с одинаковым зарядом ядра, обладающее не только химическими, но и физическими свойствами (имеются в виду: температура плавления, температура кипения, плотность, электропроводность и т. д.).
Молекула – это мельчайшая частица вещества, обладающая всеми его химическими свойствами и состоящая из одного или нескольких атомов.
Масса (m) – это мера силы (F), воздействующей на тело для придания ему единичного ускорения (а) 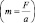 [16]. Масса измеряется в килограммах (кг), граммах (г), миллиграммах (мг), атомных единицах массы.(1 а.е.м. ≡ 1,66∙10–27 кг). Иногда измеряют относительную массу, которая представляет собой безразмерную величину, численно равную 1 а.е.м.
[16]. Масса измеряется в килограммах (кг), граммах (г), миллиграммах (мг), атомных единицах массы.(1 а.е.м. ≡ 1,66∙10–27 кг). Иногда измеряют относительную массу, которая представляет собой безразмерную величину, численно равную 1 а.е.м.
Молекулярная масса 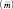 – это масса одной молекулы.
– это масса одной молекулы.
Количество вещества – это количество молекул вещества, измеряемое в молях (1 моль ≡ 6,022∙1023 штук). Масса одного моль вещества измеряется в единицах массы (килограммы, граммы, миллиграммы).
6,02·1023 – число Авогадро (NA), равное отношению массы одного грамма к массе атома водорода 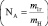 ;
;
6,02·1023 моль–1 – постоянная Авогадро, являющаяся коэффициентом пропорциональности между безразмерной единицей измерения количества (штуки) и молью[17];
Молярная масса (M) – это величина, численно равная массе одного моль вещества, но измеряемая в г/моль или кг/моль. Если молярная масса измеряется в г/моль, то её численное значение равно молекулярной массе измеряемой в а.е.м. Иногда молярная масса определяется как отношение данной массы вещества к количеству вещества данной массы.
Степень окисления атома – это воображаемый заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов.
Валентность атома – это количество его неспаренных электронов, взаимодействующих с электронами другого атома.
Химической связью называются силы, обусловленные взаимодействием электронов различных атомов и объединяющие их в одну молекулу. Под количеством связей в молекуле подразумевают число электронных пар, участвующих в формировании этих сил.
Ковалентность атома (суммарная валентность) – это сумма валентности и количества связей, образованных спаренными электронами данного атома или другого атома[18].
Функциональной связью называется химическая связь молекулы, участвующая в протекании реакции.
Функциональность молекулы – это количество её функциональных связей.
1. Дайте определения основополагающих понятий химии.
2. Что такое функциональная связь?
