
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.4. Скорость химических реакций
Раздел химии, изучающий скорости химических реакций называется химической кинетикой.
Если под скоростью движения подразумевают векторную величину 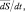 где t – время; S – вектор перемещения, то скоростью химической реакции по веществу А (v(А)) называется скалярная величина
где t – время; S – вектор перемещения, то скоростью химической реакции по веществу А (v(А)) называется скалярная величина 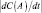 ,
,
где С(А) – концентрация или масса реагирующего вещества. Другими словами, если под скоростью движения подразумевают скорость направленного приращения расстояния, то скоростью химической реакции по веществу А называется абсолютное значение скорости приращения концентрации или массы вещества А. Например, если скорость реакции
2NO + O2 = 2NO2
по кислороду равна 0,01 моль/л∙с[20], то при тех же самых условиях скорость этой же реакции по NO окажется равной 0,02 моль/л∙с, потому что, согласно уравнению реакции, оксида азота (II), расходуется в 2 раза больше, чем кислорода. При этом, скорость реакции по оксиду азота (IV) также равна 0,02 моль/л∙с. Во избежание зависимости значения скорости от выбора вещества пользуются понятием «скорость химической реакции».
Скоростью химической реакции (v) называется скалярная величина 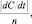 где n – стехиометрический коэффициент при реагирующем веществе или продукте реакции. Иными словами, скоростью химической реакции называется отношение скорости химической реакции по веществу к стехиометрическому коэффициенту этого вещества. Для рассмотреной реакции v = 0,01 моль/л∙с независимо от того, расход какого из реагирующих веществ измеряется. Скорость реакции, определённая по образованию продукта реакции, при этом окажется равной также 0,01 моль/л∙с.
где n – стехиометрический коэффициент при реагирующем веществе или продукте реакции. Иными словами, скоростью химической реакции называется отношение скорости химической реакции по веществу к стехиометрическому коэффициенту этого вещества. Для рассмотреной реакции v = 0,01 моль/л∙с независимо от того, расход какого из реагирующих веществ измеряется. Скорость реакции, определённая по образованию продукта реакции, при этом окажется равной также 0,01 моль/л∙с.
В простейших случаях мономолекулярных реакций твёрдых веществ, т. е. в случаях превращений молекул твёрдых веществ без взаимодействия с другими веществами, концентрация представляет собой неизменную плотность. Поэтому скорость таких реакций иногда определяют через изменение массы m:
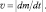
Например, для реакции[21] Cu(OH)2(к.) = СuО + H2О
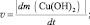
для реакции 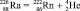
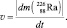
Равенства с Cu(OH)2 описывают реакцию разложения, протекающую без изменения состава ядер атомов. Равенства с 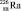 представляют реакцию распада, протекающую с разрушением ядра атома. В обоих случаях скорость процесса пропорциональна массе m разрушающегося вещества:
представляют реакцию распада, протекающую с разрушением ядра атома. В обоих случаях скорость процесса пропорциональна массе m разрушающегося вещества:
v = km, (2.10)
где k – константа скорости химической реакции. Причём, константа скорости реакции распада называется постоянной распада. Выражение (2.10) иначе можно записать так:
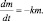
Строго говоря, величина 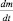 уже не является скоростью химической реакции, поскольку приведена без модуля. Величина
уже не является скоростью химической реакции, поскольку приведена без модуля. Величина 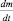 – представляет собой отрицательное изменение (уменьшение) массы во времени, т. е.
– представляет собой отрицательное изменение (уменьшение) массы во времени, т. е. 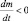 .
.
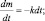
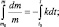
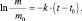
Полагая, что t0 = 0, можно записать m = mо∙e–kt.
Поскольку m = NM; m0 = N0M, где М – молекулярная масса вещества; N0 и N – количество молекул вещества в начальный момент времени и по истечении времени t соответственно, то можно записать
N = No∙ e–kt. (2.11)
Обозначив время, в течение которого разлагаются или распадаются половина молекул (период полураспада) через Т, последнее равенство можно преобразовать:
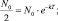
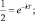
kT = ln2.
Если равенство (2.11) представить в виде
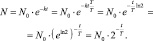
То, получается, что
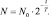 (2.12)
(2.12)
Равенства (2.11) и (2.12) представляют собой две формы закона радиоактивного распада, широко используемого при изучении реакций самопроизвольного распада радиоактивных элементов, таких как уран, нептуний, плутоний и др. Радиоактивными их стали называть из-за радиации, нередко сопровождающей распад[22]. Критерием устойчивости таких элементов как раз и является период полураспада. Как видно из предыдущих рассуждений, закон радиоактивного распада представляет собой лишь частный случай законов химической кинетики.
Следует отметить, что скорости мономолекулярных реакций разложения газообразных и растворённых веществ пропорциональны концентрации C лишь при небольших значениях концентраций. В частности, скорость разложения водного раствора гидроксида меди подчиняется равенству:
v = kC (2.13)
только при невысоких значениях С.
Из (2.10) и (2.13) следует, что 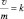 или
или 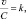 где
где  или
или  – удельная скорость химической реакции.
– удельная скорость химической реакции.
Удельная скорость мономолекулярных химических реакций постоянна, т. е. не зависит от массы или концентрации вещества.
Понятие «удельная скорость» применимо только к мономолекулярным процессам и неприменимо к реакциям, протекающим в результате столкновения молекул различного состава. Поэтому, в дальнейшем будем анализировать только скорость, не прибегая к рассмотрению удельной скорости.
Скорость реакций распада не зависит от температуры. Скорости же химических реакций, не сопровождающихся изменением состава ядра, в том числе и реакций разложения, зависят от температуры. Установлено, что при повышении температуры на каждые 10 °С скорость большинства таких реакций увеличивается в 2–4 раза.
Рассмотренные выше процессы относятся к реакциям первого порядка, т. к. их скорости зависят от концентрации (или массы) вещества в первой степени.
Скорости бимолекулярных реакций растворённых или газообразных веществ, т. е. скорости превращений, протекающих в результате химического взаимодействия двух молекул разных веществ А и В описываются равенством:
v = k [A] [B],
где [A] и [B] – концентрации веществ А и В соответственно, k константа скорости химической реакции. Например, для процесса
H2 + I2 = 2HI;
v = k [H2] [I2]. (2.14)
Тримолекулярные реакции протекают в результате столкновения трёх молекул[23], например:
2NO + O2 = 2NO2.
Скорость приведённой реакции описывается равенством
v = k [NO]2∙[O2]. (2.15)
На основании равенств (2.13)–(2.15) был сформулирован закон действия масс, который гласит: «Скорость простейшей (элементарной) реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам». При этом под элементарными подразумеваются реакции, протекающие в одну стадию. Показатель степени концентрации вещества в уравнениях для скорости химической реакции принято называть порядком реакции по этому веществу. Сумма порядков реакции называется общим порядком реакции. Например, порядок реакции (2.14) по водороду равен единице, по йоду – тоже единице. Общий порядок этой реакции равен двум, поэтому она относится к реакциям второго порядка. Порядок реакции (2.15) по NO равен двум, а по кислороду равен единице. Общий порядок реакции (2.15) равен трём, поэтому она относится к реакциям третьего порядка. Однако, следует иметь в виду, что реакции, описанные уравнениями (2.8) и (2.9) не могут быть простыми, потому что для этого необходимо столкновение десяти или даже четырнадцати молекул. Причём, трёх различных веществ. Вероятность такого события, практически равна нулю. Скорости реакций (2.8) и (2.9) не подчиняются закону действия масс в его классической формулировке, потому что протекают по сложному механизму, представляющему собой последовательность многочисленных мономолекулярных, бимолекулярных, тримолекулярных реакций. Общий порядок реакций, подчиняющихся закону действия масс, не может превышать 3.
В общем случае скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, определяемых экспериментально. То есть, для реакций (2.8) и (2.9) можно записать:
v = k∙[KMnO4]a∙[Na2SO3]b∙[H2SO4]C; (2.16)
v = k∙[K2Cr2O7]f∙[H2SO4]g∙[KI]h, (2.17)
где a, b, c, f, g, h – экспериментально определяемые порядки реакций по соответствующему веществу, отличные от их стехиометрических коэффициентов.
Следует подчеркнуть, что уравнения (2.14)–(2.17) справедливы для процессов протекающих в растворе или газовой фазе. Если же взаимодействующие вещества находятся в твёрдом состоянии, например
Fe + S = FeS,
то скорость реакции прямо пропорциональна поверхности реагирующих веществ. На величину константы скорости большое влияние оказывает присутствие катализаторов и ингибиторов. Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами. Вещества, которые замедляют скорость химических реакций, называют ингибиторами. Например, реакция 2SO2 + O2 = 2SO3 протекает значительно быстрее в присутствии V2O5. А окисление металлических изделий (коррозия), соприкасающихся с растворами, может быть предотвращено добавлением таких ингибиторов как NaNO2, K2CrO4, K2Cr2O7, Na3PO4 и др.
Примеры решения задач
1. Для реакции, подчиняющейся закону действия масс, определить во сколько раз изменится скорость реакции, если концентрацию первого вещества увеличить в 2 раза, а концентрацию второго уменьшить в 2 раза?
N2 + 3H2 = 2NH3;
2СО + О2 = 2СО2.
Прежде чем приступить к решению задачи необходимо определиться какая из двух реакций подчиняется закону действия масс. Общий порядок первой реакции равен 4. Поэтому она не может подчиняться закону действия масс. Общий порядок второй реакции равен трём. Значит, именно реакция окисления угарного газа подчиняется закону действия масс.
|
Дано:
|
Решение: v = k [CO]2∙[O2];
|
|
|
Ответ: 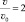 .
.
2. Определить постоянную распада k калифорния (Сf) если период его полураспада T равен одному году. Сколько нераспавшегося калифорния останется от 1 кг через 1,5 года хранения.
|
Дано: Т = 1 год t = 1,5 года mо = 1 кг |
Решение: Взаимосвязь постояной распада и периода полураспада любого радиоактивного вещества определяется равенством kT = ln2. |
|
k – ? m – ? |
Следовательно
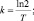
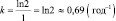 .
.
I способ нахожения m
m = mо∙e–kt;
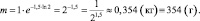
II способ нахождения m
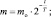
m = 1∙2–1,5 ≈ 0,354 (кг) ≡ 354 (г).
Ответ: k ≈ 0,69 год–1; m ≈ 354 г.
Задачи для самостоятельного решения
1. Для реакции, подчиняющейся закону действия масс, определить во сколько раз изменится скорость реакции, если концентрации обоих реагирующих веществ увеличить в 3 раза?
СО2 + H2 = CO + H2O;
2С2Н2 + 5О2 = 4СО2 + 2Н2О.
2. Определить постоянную распада кюрия (Сm) если период его полураспада равен 106 лет. Сколько не распавшегося кюрия останется от 300 г. через 500 000 лет.
3. Определить размерность и значение константы скорости для каждой из следующих химических реакций:
А → С;
А + В = С;
2А + В = С,
если во всех трёх случаях:
– реакции подчиняются закону действия масс;
– d[C]/dt = 0,5 моль/л∙с;
– [A] = 0,2 моль/л.
В последних двух реакциях [В] = 0,3 моль/л.
1. Что такое химическая кинетика? Дайте определение скорости химической ре акции по веществу и скорости химической реакции.
2. Что такое мономолекулярная реакция? Бимолекулярная? Тримолекулярная? Приведите конкретные примеры. Возможно ли протекание тетрамолекулярных и пентамолекулярных реакций?
3. Сформулируйте закон действия масс и расскажите о границах его применимости.
4. Как влияют на скорость химической реакции температура, катализаторы, ингибиторы?

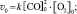
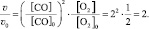
 – ?
– ?