
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.5. Теоретические основы органической химии
Классическая химия разветвилась на огромное количество самостоятельных разделов: органическая химия, неорганическая химия, аналитическая химия, физическая химия, коллоидная химия и так далее. В предыдущих параграфах раздела «Химия» рассматривались закономерности, изучаемые всеми этими разделами и поэтому относящиеся к общей химии. То есть, общая химия – это наука, изучающая наиболее общие химические закономерности, рассматриваемые всеми разделами химии.
В следующих параграфах будут изложены закономерности, изучаемые органической химией.
Органическая химия – раздел химии, изучающий химические свойства органических веществ.
Разумеется, при таком определении возникает вопрос, а что такое органические вещества?
Органические вещества – соединения четырёхвалентного углерода, за исключением нескольких веществ, традиционно считающихся неорганическими (СО2; Н2СО3; Na2СО3, СS2 и др.). То есть, нет строгой границы, разделяющей вещества органические и неорганические. Например, состав и строение угольной кислоты Н2СО3,
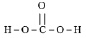
совершенно аналогичны составу и строению щавелевой кислоты Н2С2О4,
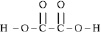
Однако, в силу условной традиции, первую принято считать неорганическим соединением, а вторую органическим.
Теоретической основой всей органической химии по сей день, остается теория химического строения органических веществ, решающую роль в развитии которой, сыграл Александр Михайлович Бутлеров (1828–1886 гг.), сформулировавший основные идеи этой теории в виде следующих положений:
1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентностям.
2. Свойства веществ зависят не только от природы и количества атомов, входящих в состав молекулы, но и от порядка соединения атомов в молекуле.
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
4. Атомы и группы атомов в молекулах веществ, взаимно влияют друг на друга.
Второе положение теории строения органических веществ объяснило, в частности, явление изомерии – возможность существования соединений, описываемых одной и той же молекулярной формулой, но обладающих различными свойствами. Именно различия в порядке соединения атомов в молекуле, то есть различия в строении, стали объяснением различия свойств молекул одинакового состава. Вещества, описываемые одной и той же молекулярной формулой, но отличающиеся строением называются изомерами. Реакции превращения одних изомеров в другие называются реакциями изомеризации. Например, пентан, обладающий температурой кипения 36,1 °С и описываемый молекулярной формулой С5Н12, при нагревании в присутствии катализатора может превращаться в изопентан (2-метилбутан),
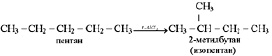 (2.18)
(2.18)
обладающий температурой кипения 27,8 °С, хотя и описываемый точно такой же молекулярной формулой.
