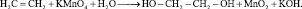Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.7. Алкены. Алкины. Алкадиены
Углеводороды, в молекулах которых присутствует двойная (С = С) или тройная (С ≡ С) углерод – углеродная связь, называются непредельными углеводородами. Связи С = С и С ≡ С в отличие от ординарных называют кратными. Кратные связи являются функциональными группами углеводородов. Фрагменты органических молекул, строение и состав которых отличаются от строения и состава предельных углеводородов называются функциональными группами. Непредельные углеводороды, имеющие одну двойную связь называются углеводородами ряда этилена или алкенами (олефинами) и описываются общей формулой СnH2n, совпадающей с общей формулой циклоалканов. Простейшим алкеном является этилен (тривиальное название) или этен (систематическое название):
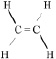
Систематические названия алкенов образуют путём изменения суффикса – ан соответствующего предельного углеводорода на суффикс – ен. При этом положение двойной связи указывают цифрой в конце названия. Например,
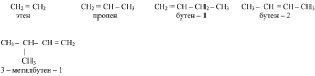
На примере последнего соединения видно, что если в цепи молекулы присутствуют и кратная связь и заместитель, то нумерация углеродных атомов начинается с края, к которому бли-
же кратная связь.
Непредельные углеводороды, имеющие одну тройную связь, называются углеводородами ряда ацетилена или алкинами и описываются общей формулой СnH2n–2. Простейшим алкином является ацетилен (тривиальное название) или этин (систематичес-
кое название):
Н–С ≡ С–Н.
Систематические названия алкинов образуются заменой суффикса – ан соответствующего предельного углеводорода на суффикс – ин. Положение тройной связи указывают цифрой в конце названия. Например,
СН ≡ С–СН2–СН3 СН3–С ≡ С–СН3.
бутин – 1 бутин – 2
Непредельные углеводороды, имеющие две двойные связи, называются диеновыми углеводородами и описываются общей формулой СnH2n–2, совпадающей с общей формулой алкинов. Простейшим диеновым углеводородом является бутадиен – 1,3:
СН2 = СН – СН = СН2.
Систематические названия диеновых углеводородов образуются заменой суффикса -ан соответствующего предельного углеводорода на суффикс -диен. Положение двойных связей указывают цифрами в конце названия. Например,
СН2 = СН–СН2–СН = СН2.
пентадиен – 1,4
Пространственное строение непредельных углеводородов.
В структурной формуле этилена две связи, соединяющие атомы углерода и обозначаемые одинаковыми чёрточками, на самом деле не эквивалентны друг другу.
В молекуле этилена, также как и в молекуле этана каждый атом углерода обладает 4-мя валентными электронами. Но в молекуле этилена в отличие от молекулы этана гибридизованы только три (один s и два p) электрона, образующих три sp2 орбитали. Орбиталь четвёртого валентного р – электрона каждого углерода остаётся без изменений. Два из трёх гибридизованных sp2 электрона образуют связь с атомами водорода, третий – с другим атомом углерода. Связь, образованная электронами углерода, вращающимися по гибридизованным sp3, sp2, sp орбиталям является σ – связью[25]. Оставшийся без изменений четвёртый р – электрон образует в молекуле этилена с аналогичным р – электроном другого атома вторую углерод – углеродную связь, которая называется π – связью[26]. Таким образом, двойная углерод – углеродная связь в молекуле этилена представляет собой совокупность одной σ и одной π связей (рис. 2.4).

а б
Рис. 2.4. Образование σ и π-связей в молекуле этилена. Перекрывание вертикальных орбиталей представляет собой π-связь (а). Плоскость, образуемая четырьмя атомами водорода перпендикулярна плоскости рисунка.
Обозначение С–С символизирует в данном случае σ – связь, образованную перекрыванием sp3 орбиталей атомов углерода (б)
Тройная связь в молекуле ацетилена представляет собой совокупность одной σ-связи и двух π-связей, расположенных перпендикулярно друг к другу.
В молекуле бутадиена двойные связи разделены одной ординарной связью. Но близость соседних π-связей приводит к тому, что центральные p-электроны частично перекрываются также между собой, хотя и в меньшей степени, чем с р-электронами крайних атомов (рис. 2.5).
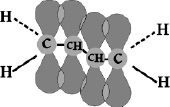
Рис. 2.5. Сопряжённые связи в молекуле бутадиена – 1,3. Плоскость, образованная четырьмя атомами углерода, перпендикулярна плоскости рисунка.
На этой же плоскости расположены все атомы водорода
π-связи, разделённые между собой одной ординарной связью и перекрывающиеся вследствие близости взаиморасположения называются сопряжёнными π-связями. Следует подчеркнуть что в пентадиене – 1,4 такого сопряжения нет. π-Связь сравнительно легко разрывается, так как она значительно слабее σ-связи. Поэтому именно π-связь обеспечивает высокую реакционную способность непредельных углеводородов в реакциях соединения.
Физические свойства
Среди алкенов этен, пропен и бутен при нормальных условиях газообразны, от пентена С5Н10 до октадецена С18Н36 включительно эти углеводороды находятся в жидком состоянии, а начиная с нонадецена С19Н38 – в твёрдом. Среди ацетиленовых углеводородов газообразными при нормальных условиях являются только этин и пропин. 1,3 – Бутадиен при нормальных условиях – газ. Изменения физических свойств ненасыщенных углеводородов подчиняются тем же закономерностям, что и физические свойства насыщенных углеводородов: при увеличении молекулярной массы и разветвления углеводородов повышается температура их кипения.
Химические свойства
Реакции соединения. Для непредельных углеводородов реакции соединения являются наиболее характерными. Например, они легко обесцвечивают бромную воду:
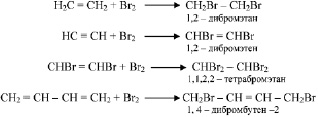
присоединяют воду:
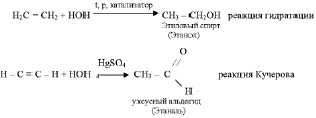
этилен способен присоединять даже кислород

Практически все непредельные углеводороды присоединяют галогеноводороды:
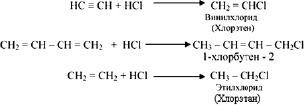
Порядок присоединения галогеноводорода к пропену и последующим углеводородам ряда эилена регламентируется правилом Марковникова:
Водород присоединяется к наиболее, а атом галогена к наименее гидрированному атому углерода:
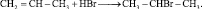
2-бромпропан
Молекулы всех непредельных углеводородов способны соединяться друг с другом, образуя полимеры:
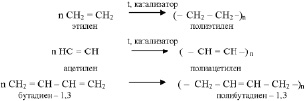
Реакция соединения многих одинаковых молекул в более крупные называется реакцией полимеризаци. Вещества, молекулы которых представляют собой цепи, состоящие из множества повторяющихся звеньев, называются полимерами. Молекулы полимеров иногда называют макромолекулами. Исходные вещества при получении полимеров называются мономерами. То есть, мономером полиэтилена является этилен, мономером полиацетилена – ацетилен и т. д.
Реакции разложения. Без доступа воздуха, при повышенных температурах, непредельные углеводороды, также как и предельные могут образовывать углерод и водород:
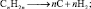
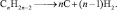
Реакции замещения. В результате сгорания непредельных углеводородов происходит замещение атомов водорода и углерода атомами кислорода


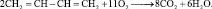
Реакции обмена. В силу того, что тройная связь в молекуле ацетилена весьма значительно стягивает на себя электроны, принадлежащие атомам водорода, то последние оказываются менее прочно связанными с молекулой по сравнению с атомами водорода этилена. Поэтому реакции обмена характерны, прежде всего, для углеводородов ацетиленового ряда с не более, чем одним заместителем:

амид ацетиленид
натрия натрия
1. Составьте уравнения реакций соединения с водородом:
– этилена;
– ацетилена;
– бутадиена.
2. Дайте систематические названия следующим соединениям:
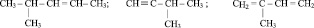
3. Напишите структурные формулы следующих веществ:
2,3 – диметилпентен – 2; 3,4 – диметилгексин – 1; 2,4 – диметилпентадиен – 1,4
4. Какую Вы знаете особенность химических свойств алкинов, отличающую их от алкенов и алкадиенов?
5. Пользуясь равенствами (2.6) и (2.7) расставте коэффициенты в схеме реакции: