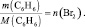Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.8. Ароматические углеводороды (арены)
Молекулы непредельных углеводородов также как и предельных могут представлять собой замкнутые цепи – циклоалкены, циклоалкины, циклоалкадиены:
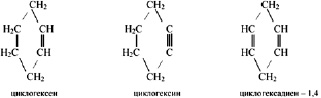
Циклические углеводороды, содержащие в своём цикле три чередующиеся двойные связи называются ароматическими углеводородами.
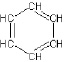
Простейшим ароматическим углеводородом является бензол, описываемый молекулярной формулой С6Н6:
Радикал, полученный отщеплением одного атома водорода от молекулы бензола (С6Н5–) называется фенилом:
С6Н5–С6Н5
дифенил
Согласно систематической номенклатуре все ароматические соединения рассматриваются как замещённые бензола и цифрами показывается место того или иного заместителя. Например,

Однако следует иметь в виду, что до сих пор нередко используются тривиальные названия ароматических углеводородов или используется другая номенклатура.
Также как и в бутадиене – 1,3 двойные связи бензола сопряжены, а атомы углерода обладают sp2 – гибридизацией своих орбиталей. Но, в отличие от бутадиена – 1,3, сопряжение в бензоле приводит к равному перекрыванию орбитали каждого р – электрона соседними р-электронами. То есть, фактически в молекуле бензола вместо чередования двойных и ординарных связей, атомы углерода объединены единой π – системой шести p – электронов, расположенной перпендикулярно плоскости шести σ – связей. Чтобы подчеркнуть равенство всех углерод-углеродных связей в молекуле бензола, его структурную формулу часто представляют следующим образом:
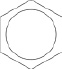
Каждый угол такого шестиугольника символизирует  , т. е. углерод и водород, объединённые σ-связью.
, т. е. углерод и водород, объединённые σ-связью.
Физические свойства
Бензол – бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Его температура кипения 80,1 °С. При охлаждении он легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С. Температуры кипения ароматических углеводородов закономерно повышаются с увеличением их молекулярных масс.
Химические свойства
Реакции соединения. Бензол присоединяет галогены под действием солнечного света или ультрафиолетовых лучей:
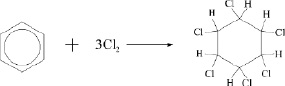
гексахлорциклогексан
При нагревании и в присутствии катализаторов бензол присоединяет водород:
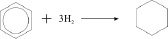
Реакции разложения. При нагревании без доступа воздуха бензол, как и все углеводороды может распадаться на углерод и водород:
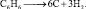
Реакции замещения. Атомы водорода в бензоле замещаются галогенами в присутствии катализатора – солей железа (III):
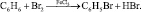
Обратите внимание: в отсутствие катализатора между бензолом и галогенами протекает реакция соединения, а в присутствии катализатора – реакция замещения.
Бензол и его гомологи горят на воздухе коптящим пламенем:

Реакции обмена. При нагревании, в присутствии серной кислоты, бензол взаимодействует с азотной кислотой
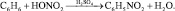
Нитробензол
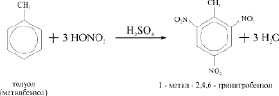
Ещё легче в реакцию обмена с азотной кислотой вступают гомологи бензола, например толуол С6Н5СН3:
Пример решения задачи
К 39 г. бензола в присутствии хлорида железа (III) добавили 1 моль брома. Какие вещества и сколько граммов их получилось после реакции?
Прежде чем приступить к количественным расчётам, необходимо записать уравнение реакции:
39 г. 1 моль m(С6Н5Br) m(HBr)
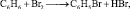
78 г/моль 160 г/моль 157 г/моль 81 г/моль
из которого видно, что продуктами взаимодействия являются бромбензол и бромоводород.
|
Дано: |
Решение: Для взаимодействия с 39 г. бензола необходимо только 0,5 моль брома. Действительно, согласно следствия закона эквивалентов:
|
|
m(С6Н5Br) – ? m(HBr) – ? |
В данном случае
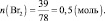
То есть, Br2 взят в избытке. Полностью прореагирует только бензол, взятый в недостатке.
1 способ
окончания решения задачи
(с помощью следствия закона эквивалентов)
Для пары веществ – бензол и бромбензол – следствие закона эквивалентов запишется следующим образом:
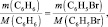
откуда
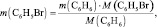
то есть
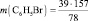
или
m(С6Н5Br) = 78,5 г
для пары – бензол и бромоводород:
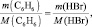
откуда
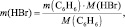
то есть
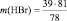
или
m(HBr) = 40,5 г.
2 способ
окончания решения задачи
(по правилам составления пропорций)
На основании уравнения реакции можно составить следующие пропорции:
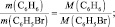
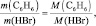
откуда
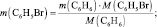
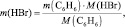
то есть
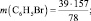
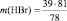
или
m (С6Н5Br) = 78,5 г;
m(HBr) = 40,5 г.
3 способ
окончания решения задачи
(с помощью логических заключений)
По условию задачи прореагировало 0,5 моль бензола:
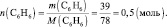
Из уравнения реакции слеует, что при взаимодействии 0,5 моль C6H6 образуется 0,5 моль С6Н5Br и 0,5 моль HBr. То есть
m(С6Н5Br) = М(С6Н5Br)∙0,5 = 157∙0,5 = 78,5 (г);
m(HBr) = М(HBr)∙0,5 = 81∙0,5 = 40,5 (г);
Ответ: m(С6Н5Br) = 78,5 г, m(HBr) = 40,5 г.
Задачи для самостоятельного решения.
1. Газообразную смесь из 1 моль бензола и 142 г. хлора подвергли ультрафиолетовому облучению. Какой продукт, и какой массы при этом образовался? Решить задачу тремя способами.
2. Определить количество бензола, израсходованного на образование 369 г. нитробензола.
1. В чём состоит особенность строения бензола, отличающая его от неароматических углеводородов?
2. Дайте систематические названия следующим соединениям:
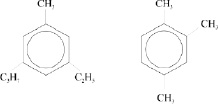
3. Охарактеризуйте химические свойства ароматических углеводородов на примере конкретных реакций.