
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.2.2. Модель «Орегонатор»
Одной из первых моделей, объясняющих колебательное течение химического процесса, стал механизм, получивший название «Орегонатор».
В рамках этой модели возможен вариант водного раствора исходных веществ, включающий в себя следующие компоненты: серную кислоту Н2SO4, малоновую кислоту НООС–СН2–СООН, сульфат церия (III) Ce2(SO4)3, бромат калия KBrO3 и бромид калия KBr. В этом случае ионное уравнение прямой реакции превращения Ce3+ в Ce4+ может быть представлено следующим образом:
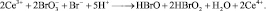
стадии прямой реакции:
1. 
2. 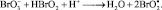
3. 
Ионное уравнение обратной реакции превращения Ce4+ в Ce3+:
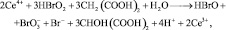
стадии обратной реакции:
4. 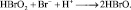
5. 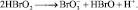
6. 
7. 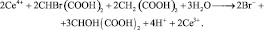
Суммарный процесс, объединяющий прямую и обратную реакции (с учётом первой стадии прямой реакции), не включает ионы церия и протекает с выделением тепла:
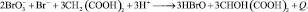
То есть, Ce3+ и Ce4+ участвуют лишь в качестве катализатора.
Всю реакцию можно представить в виде циклических процессов, представленных на рис. 2.12. После внесения в раствор исходных веществ, реакционная смесь претерпевает все семь стадий с 1 по 7, после чего процесс замыкается в цикл: 3,4,5,6, 7, 3, 4, 5,6,7, 3, 4, 5, 6, 7…и так далее.
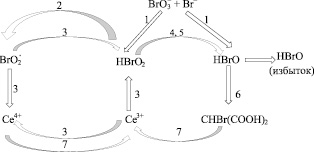
Рис. 2.12. Условная схема орегонатора. Цифры 1–7 символизируют номер стадии
Соответствующие молекулярные уравнения могут выглядеть так:
прямая реакция
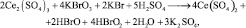
стадии прямой реакции
1. 
2. 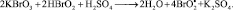
3. 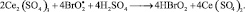
Обратная реакция
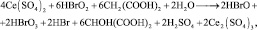
стадии обратной реакции:
4. 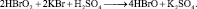
5. 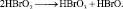
6. 
7. 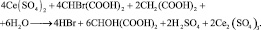
Суммарный процесс, объединяющий прямую и обратную реакции (с учётом первой стадии прямой реакции), не включает соли церия и является экзотермическим:
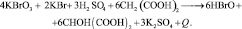
То есть, соль церия участвует в процессе лишь в качестве катализатора.
Из последнего уравнения можно сделать вывод, что если для поддержания физических процессов самоорганизации системы необходимо непрерывно подводить и отводить ту или иную энергию (тепловую, механическую, электрическую и т. д.), то для поддержания химических процессов самоорганизации необходимо подводить и выводить химические вещества. В данном случае, подводить: KBrO3, КBr, H2SO4, СН2(СООН)2, а выводить НBrO, СНОН(СООН)2, K2SO4.
То есть, физические и химические синергетические системы являются открытыми – обменивающимися с внешней средой энергией и веществами.
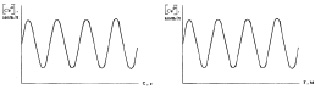
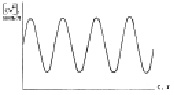
Рассмотренная модель, действительно, объясняла наблюдаемые простейшие колебания (рис. 2.13).
а б
в
Рис. 2.13. Изменения концентрации Се4+ во времени (а),
в пространстве (б), одновременно во времени и пространстве (в)
Если реакция протекает в присутствии ферроина, то колебания, представленные на рис. 2.13 (а) проявляются чередованием синего и красного цвета перемешиваемого реакционного раствора. Колебания рис. 2.13 (б) представляют собой неподвижные разноцветные концентрические круги (рис. 2.14) на поверхности неперемешиваемого раствора в чашке Петри. Колебания рис. 2.13 (в) проявляются разноцветными концентрическими кругами, непрерывно расширяющимися от центра к периферии.
Однако, экспериментаторы, варьируя начальные условия опытов, получали иногда сложно-периодические и хаотические колебания (рис. 2.15), возникновения которых орегонатор объяснить не мог.

а б
Рис. 2.15. Нестационарные сложно-периодические колебания концентрации Се4 + (а) и хаотические колебания [Се4+]((б)
