
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Drug development: как появляются лекарства
Появление нового лекарства – процесс не быстрый и крайне непростой. На создание нового препарата уходят годы, и далеко не всегда новая разработанная молекула проходит все этапы исследований безболезненно и завершается появление нового препарата в продаже. Этапы этого большого пути приведены на рис. 6.
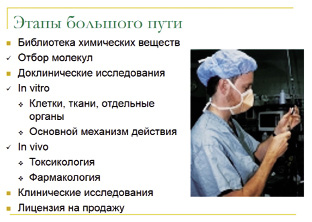
Рис. 6. Этапы большого пути
Поиск молекулы
Поиск молекулы, которая в дальнейшем станет лекарственным средством – процесс, основанный не только на имеющихся знаниях фармакологии и физиологии, но и на творческом и неординарном подходе со стороны ученых. Иногда – это результат длительных расчетов, а иногда – удачного стечения обстоятельств. Существуют электронные базы как существующих, так и виртуальных молекул, в которых также может производиться отбор кандидата в новый лекарственный препарат. После отбора молекул и их базовых тестов «в пробирке» (на изолированных мембранах, органах или тканях животных и человека), выбирается лучший на данном этапе вариант, и очень часто сразу патентуется, для сохранения интеллектуальной собственности. Далее молекула попадает в руки физиолога и начинается этап доклинических исследований.
Доклинические исследования
Несмотря на продолжающиеся споры о целесообразности экспериментов на животных, на сегодняшний день, мы не можем от них отказаться, и вынуждены получать первые представления о фармакодинамике, фармакокинетике, токсичности и переносимости препарата на животных. Причем для ряда тестов используются только различные ткани, а для определенных задач и введение вещества лабораторному животному. На сегодняшний день это обязательный этап проверки исследуемого вещества, в том числе и с точки зрения законодательства. Изучают острую токсичность (т. е. влияние приёма одной дозы препарата), подострую токсичность (исследуют многократное введение вещества); особое внимание уделяется влиянию на репродуктивную и иммунную системы, и возникновение тератогенных эффектов. При отсутствии явных негативных влияний, и при наличии ожидаемого от вещества эффекта рассчитывается так называемое соотношение «доза–ответ», устанавливается потенциально летальная доза. Успешные доклинические испытания к сожалению не всегда означают, что первое применение вещества у человека пройдет ожидаемо и безопасно, поскольку разумеется организм человека имеет ряд существенных отличий от животных, и именно это часто является аргументом для сторонников отказа от экспериментов на животных, но к сожалению, на сегодняшний день у нас нет иной возможности получать самую первую информацию о препарате, кроме как из доклинических исследований.
Получение разрешения на клинические исследования
Наличие результатов доклинических исследований (токсикологии, исследований in vitro, и экспериментов на животных) является обязательным для получения разрешения на проведение исследований на человеке.
Практически во всех странах имеются соответствующие административные органы, регулирующие клинические испытания. В России это Минздрав России (Департамент государственного регулирования обращения лекарственных средств), в США – Управление по контролю за пищевыми продуктами и лекарственными веществами (FDA), в Европе – Европейское управление по контролю за новыми веществами для людей (EMEA). Без разрешения соответствующего регуляторного органа, проведение исследований на людях недопустимо. Также любое клиническое исследование обязательно рассматривается и одобряется специальным комитетом по этике.
Фазы КИ лекарственных препаратов
Существует IV фазы (этапа) КИ (табл. 2, рис. 7).
Фаза I. Это первый опыт применения нового лекарственного препарата на человеке. Это ответственейший этап, главная цель которого убедиться в отсутствии явной токсичности и принять решение о целесообразности дальнейших исследований препарата. Эта фаза проводится на здоровых добровольцах (участвующих в исследовании за материальное вознаграждение). Исключение составляют только высокотоксичные препараты (например цитостатики), исследование которых на здоровых людях в силу огромного числа серьезных нежелательных эффектов неэтично и недопустимо. Такие препараты исследуются только на лицах с заболеваниями, от которых предназначены. В ходе данной фазы КИ исследователи получают первые данные о фармакокинетике и фармакодинамике препарата, о его потенциальной токсичности, и при хорошем стечении обстоятельств – первое представление об эффективных дозах, которые и будут тестироваться в следующей фазе КИ.
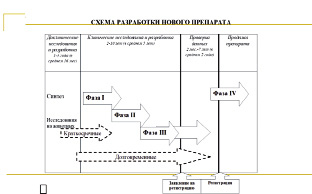
Рис. 7. Схема разработки нового лекарственного препарата
Однако все участники первой фазы все равно подвергаются риску, поскольку ни один эксперимент на животных не может полностью гарантировать безопасность препарата на человеке. В 2006 году в Лондоне проводились исследования 1 фазы моноклональных антител TGN1412 (препарат фирмы Beringer Ingelheim, исследование проводила компания Parexel), предназначенных для лечения ревматоидного артрита, и лейкемии. Исследование проводилось на здоровых добровольцах. В первый же день эксперимента 6 участников (которым достался препарат, а не плацебо) оказались в реанимации в крайне тяжелом состоянии, с выраженными токсическими повреждениями различных органов и чудовищными отеками мягких тканей. Доклинические исследования на приматах ничего подобного не выявляли (у обезьянок отмечалось лишь незначительное увеличение лимфоузлов, разрешавшееся самостоятельно). Разразился чудовищный скандал. Пострадавшие (которым причитались страховые выплаты) тем не менее обратились в суд. Был проведен целый ряд проверок, не нашедших никаких отклонений от корректного и законного проведения данного КИ. Все это лишь еще раз доказывает, что невозможно полностью просчитать все риски для человека, и подчеркивает важность многоступенчатых КИ. Для обеспечения безопасности участников 1 фазы – подобные эксперименты проводятся только в хорошо оснащенных стационарах, где испытуемые находятся под постоянным наблюдением, где у них берется множество лабораторных и функциональных показателей, и где есть возможноcть оказания экстренной помощи, в случае развития нежелательных реакций. Обычно в I фазе участвуют до 100 испытуемых.
В среднем, около одной трети всех исследуемых препаратов отсеивается на первой фазе исследований, в связи с плохой переносимостью или плохой абсорбцией.
Фаза II. Обычно это первый опыт применения у пациентов с заболеванием, для лечения которого предполагается использовать препарат. Вторая фаза делится на IIa и IIb. Фаза IIa – это терапевтические пилотные исследования (pilot studies), т. к. полученные в них результаты обеспечивают оптимальное планирование последующих исследований. Фаза IIb – это более обширные исследования, но главная их цель – доказательства безопасности препарата. Результаты этих исследований (pivotal trial) служат основой для планирования исследований III фазы.
В исследованиях II фазы продолжается изучение фармакодинамики и фармакокинетики препарата, и его влияние на определенные параметры испытуемых (пульс, давление, уровень холестернина и т. п.). Дополнительной задачей исследований II фазы является определение терапевтического уровня дозирования лекарственного средства.
Обычно в исследованиях на фазе II участвуют от 100 до 2–3 тысяч испытуемых.
Фаза III. Многоцентровые испытания с участием больших групп пациентов (в среднем, от 2000–3000 человек, но в ряде случаев до 20–30 тысяч пациентов). Набор таких пациентов в исследование проходит в многочисленных научно-исследовательских центрах различных стран мира одновременно.
Данные, полученные в КИ III фазы, являются основой для создания инструкций по применению препарата и для решения вопроса об его регистрации и соответственно начале продаж.
Основные задачи клинических испытаний III фаза – оценка безопасности и эффективности лекарственного средства при достаточно длительном использовании пациентами с заболеванием, для лечения которого он и предназначен.
Фазу III клинических испытаний иногда делят на фазы а и b. Фаза IIIa клинических исследований служит для получения информации о безопасности и эффективности лекарственного средства в сравнительно больших группах пациентов. Исследования фазы IIIb – клинические это испытания, проводимые перед получением одобрения на лекарственный препарат и массовым производством. Информация, полученная на этой фазе испытаний, дополняет окончательные результаты исследований.
Фаза IV. Исследования проводятся после начала продажи препарата с целью получить более подробную информацию о длительном применении в различных группах пациентов и при различных факторах риска и т. д., и, таким образом, более полно оценить стратегию применения лекарственного средства. Она позволяет отследить редкие побочные эффекты, которые невозможно выявить в ходе ограниченного по времени клинического испытания. Клинические испытания IV фазы, проводимые после того, как лекарственный препарат получил одобрение, часто называют постмаркетинговыми исследованиями.
Если лекарственное средство собираются применять по новому показанию, ещё не зарегистрированному, то для этого проводятся дополнительные исследования, начиная с фазы II.
Таблица 2
Фазы КИ: основные задачи и число участников
|
Фаза |
Ориентировочное количество пациентов |
Основные задачи |
|
I |
20–100 |
Первое опыт применения нового активного вещества у человека, оценка токсичности и безопасности, определение параметров фармакокинетики |
|
II |
100–800 |
Установление эффективности, определение оптимальных режимов дозирования, оценка безопасности |
|
III |
1000–30000 |
Подтверждение данных об эффективности и безопасности, сравнительные исследования со стандартными препаратами |
|
IV |
Десятки тысяч |
Дальнейшей изучение эффективности для оптимизации применения препарата, долгосрочные исследования безопасности, оценки редких нежелательных лекарственных реакций |
Клинические испытания часто преподносят различные сюрпризы своим организаторам и спонсорам. Но иногда они бывают и приятными. Так, например, в 1996 году компания Pfizer проводила испытания нового средства для лечения артериальной гипертензии, под кодовым наименованием UK-92480. Препарат не оказывал существенного влияния на развитие гипертонии, но имел способность влиять на эректильную функцию (ученые обратили внимание на комментарии пациентов об этом удивительном эффекте вещества). Всего через 2 года препарат UK-92480 появился на рынке под названием «Виагра» и вошёл в историю фармакологии как одно из самых успешных фармацевтических открытий.
Проведение КИ – крайне дорогостоящий процесс, но в случае удачи, регистрации препарата и успешных продаж, он не просто окупается, а является прибыльным для фармкомпаний.
