
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4.1.2. Термодинамические константы одно- и двухосновных кислот в водных растворах
Рассмотрим диссоциацию одноосновной кислоты (4.1) и дикислот (4.2) и (4.3) и соответствующие константы диссоциации в любом растворителе в упрощенном виде:
![]() ,
, ![]() (4.1)
(4.1)
![]() ,
, ![]() (4.2)
(4.2)
![]() ,
,![]() (4.3)
(4.3)
Для определения термодинамических констант диссоциации рассматриваемых одно- и двухосновных кислот воспользуемся методами прямой потенциометрии и потенциометрического титрования, как наиболее наглядными и оптимальными среди известных методов. При этом требуется учитывать основные количественные законы теории растворов электролитов: закон электронейтральности, закон сохранения материального баланса, правило стехиометрии и ряд других.
Существующие методы оценок ионной силы при кислотно-основном равновесии, в связи с затруднениями полного и объективного учета концентраций всех образующихся частиц, основаны на использовании концентрации первой ионизированной частицы, например, [A−] для одноосновной и [HA-] для двухосновной кислоты. Как будет показано позже, пренебрегать равновесными концентрациями иона [A2-] в расчетах констант диссоциации не следует. Как уже отмечалось, наиболее приемлемым и плодотворным является представление кривой титрования кислот в логарифмических координатах. Равновесные концентрации неоттитрованной кислоты [HA] и иона [A−] монокислоты, а также [H2A] и частиц [HA−], [A2−], образующихся при титровании дикислоты, могут быть определены на диаграммах -lg (активность гидроксония) – lgC. Оценка значения коэффициентов активности f0, f1, f2 в уравнениях (4.1), (4.2), (4.3) проводится по закону Дебая [6]:
lg fi = -Azi2I1/2/(1+ВаI1/2), (4.4)
где A = 1.8246·106/(εT)3/2, B = (2e2NA·1000)1/2/(εkБТ)1/2, I – ионная сила раствора, определяемая в данном случае по известному уравнению: I = 0.5([HA−]·z12 + [A2−]·z22), а – расстояние наибольшего сближения ионов.
Приведем примеры определения термодинамических констант диссоциации водных растворов уксусной (одноосновной) и щавелевой (двухосновной) кислот.
В табл. 4.1 приведены данные для экспериментального определения рКа уксусной кислоты (равновесные концентрации [HA], [A-], определенные из рис. 4.1) потенциометрическим титрованием 0.1М раствора СН3СООН титрующим агентом 0.09390М раствор гидроксида натрия (прибор METROHM 632 pH-meter), расчетов ионной силы, коэффициентов активности и термодинамической константы диссоциации по (4.1).
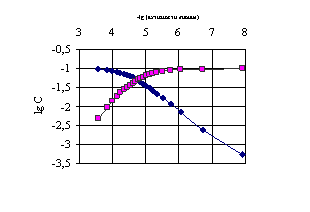
Рис.4.1. Диаграмма -log(активность гидроксония) – log C для определения равновесных концентраций ![]() - (нисходящая кривая),
- (нисходящая кривая), ![]() - (восходящая кривая)
- (восходящая кривая)
Таблица 4.1
Данные для экспериментального определения рКа уксусной кислоты
| V,млNaOH | aH+ | [HA] | [A-] | I0.5 | f1 | pKa |
| 2.0 | 7.41E-05 | 0.081413 | 0.018587 | 0.0964 | 0.9015 | 4.86 |
| 2.5 | 5.75E-05 | 0.076766 | 0.023234 | 0.1078 | 0.8916 | 4.81 |
| 30 | 4.57E-05 | 0.072119 | 0.027881 | 0.1181 | 0.8830 | 4.81 |
| 3.5 | 3.63E-05 | 0.067472 | 0.032528 | 0.1275 | 0.8752 | 4.81 |
| 4.0 | 3.02E-05 | 0.062825 | 0.037175 | 0.1363 | 0.8681 | 4.81 |
| 4.5 | 2.40E-05 | 0.058178 | 0.041822 | 0.1446 | 0.8616 | 4.83 |
| 5.0 | 2.09E-05 | 0.053532 | 0.046468 | 0.1524 | 0.8556 | 4.81 |
| 5.5 | 1.74E-05 | 0.048885 | 0.051115 | 0.1598 | 0.8500 | 4.81 |
| 6.0 | 1.45E-05 | 0.044238 | 0.055762 | 0.1670 | 0.8448 | 4.81 |
| 6.5 | 1.20E-05 | 0.039591 | 0.060409 | 0.1738 | 0.8398 | 4.81 |
| 7.0 | 9.55E-06 | 0.034944 | 0.065056 | 0.1803 | 0.8352 | 4.83 |
| 7.5 | 7.59E-06 | 0.030297 | 0.069703 | 0.1867 | 0.8307 | 4.84 |
| 8.0 | 5.89E-06 | 0.025651 | 0.074349 | 0.1928 | 0.8265 | 4.85 |
| 8.5 | 4.47E-06 | 0.021004 | 0.078996 | 0.1987 | 0.8225 | 4.86 |
| 9.0 | 3.09E-06 | 0.016357 | 0.083643 | 0.2045 | 0.8186 | 4.89 |
Математическая обработка результатов расчета термодинамических констант диссоциации рК (уксусная кислота) (последняя колонка табл. 4.1) при числе точек 15 по компьютерной программе (Приложение IV) приводит к величине рК = 4.826 ± 0.075 (литературное значение 4.75).
Щавелевая кислота, как известно, характеризуется близостью констант диссоциации, при титровании вместо предполагаемых двух скачков титрования отмечается один совместный. Поэтому прямое определение значений последовательных констант равновесий затруднено.
В табл. 4.2 представлены данные потенциометрического титрования 0.1 М раствора двухосновной щавелевой кислоты 0.09390 М раствором гидроксида натрия в буферной области 0.25 … 0.75, активности ионов гидроксония, равновесные концентрации всех частиц (![]() ), образующихся при титровании дикислоты, определенные из парной зависимости -log(активность гидроксония) – lоgC (рис. 4.2), ионная сила и коэффициенты активности
), образующихся при титровании дикислоты, определенные из парной зависимости -log(активность гидроксония) – lоgC (рис. 4.2), ионная сила и коэффициенты активности ![]() ионов
ионов ![]() , расчетные значения термодинамических констант диссоциации
, расчетные значения термодинамических констант диссоциации ![]()
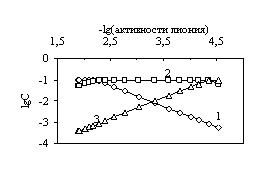
Рис. 4.2. Диаграмма -log(активность гидроксония) – log C для определения равновесных концентраций ![]() - (кривая 1),
- (кривая 1), ![]() - (кривая 2) и
- (кривая 2) и ![]() - (кривая 3).
- (кривая 3).
Таблица 4.2
Данные потенциометрического титрования раствора щавелевой кислоты раствором NaOH для расчета термодинамических констант диссоциации по уравнениям (4.2), (4.3) и (4.4)
| Vi, мл | | | | | | | | | |
| 1 | 0.0126 | 0.1000 | 0.0478 | 0.0004 | 0.1572 | 0.8520 | 0.5269 | 2.29 | 4.19 |
| 2 | 0.0123 | 0.1000 | 0.0501 | 0.0004 | 0.1608 | 0.8493 | 0.5203 | 2.28 | 4.21 |
| 3 | 0.0095 | 0.1000 | 0.0660 | 0.0005 | 0.1846 | 0.8322 | 0.4796 | 2.28 | 4.36 |
| 4 | 0.0081 | 0.1000 | 0.0758 | 0.0006 | 0.1978 | 0.8231 | 0.4590 | 2.29 | 4.44 |
| 5 | 0.0066 | 0.1000 | 0.0891 | 0.0007 | 0.2144 | 0.8121 | 0.4349 | 2.32 | 4.55 |
| 6 | 0.0052 | 0.0891 | 0.1000 | 0.0009 | 0.2275 | 0.8037 | 0.4173 | 2.32 | 4.61 |
| 7 | 0.0040 | 0.0676 | 0.1000 | 0.0012 | 0.2289 | 0.8028 | 0.4155 | 2.32 | 4.60 |
| 8 | 0.0027 | 0.0447 | 0.1000 | 0.0018 | 0.2314 | 0.8013 | 0.4122 | 2.31 | 4.61 |
| 9 | 0.0017 | 0.0282 | 0.1000 | 0.0028 | 0.2359 | 0.7985 | 0.4066 | 2.31 | 4.61 |
| 10 | 0.0009 | 0.0158 | 0.1000 | 0.0050 | 0.2450 | 0.7930 | 0.3954 | 2.34 | 4.64 |
| 11 | 0.0004 | 0.0083 | 0.1000 | 0.0100 | 0.2646 | 0.7814 | 0.3729 | 2.36 | 4.66 |
| 12 | 0.0003 | 0.0045 | 0.1000 | 0.0178 | 0.2925 | 0.7658 | 0.3440 | 2.35 | 4.68 |
| 13 | 0.0002 | 0.0027 | 0.1000 | 0.0302 | 0.3322 | 0.7453 | 0.3085 | 2.36 | 4.71 |
| 14 | 0.0001 | 0.0017 | 0.1000 | 0.0446 | 0.3733 | 0.7258 | 0.2776 | 2.37 | 4.76 |
| 15 | 0.0001 | 0.0012 | 0.1000 | 0.0645 | 0.4232 | 0.7043 | 0.2461 | 2.41 | 4.81 |
| 16 | 0.0001 | 0.0008 | 0.0977 | 0.1000 | 0.4988 | 0.6755 | 0.2082 | 2.45 | 4.84 |
Как видно из вышеприведенной табл. 4.2, равновесные концентрации ![]() сопоставимы, поэтому в расчетах все они должны быть учтены.
сопоставимы, поэтому в расчетах все они должны быть учтены.
Статистическая обработка величин констант диссоциации щавелевой кислоты по компьютерной программе (Приложение IV) приводит к следующим доверительным интервалам:
рК1 = 2.35 ± 0.10 и рК2 = 4.27 ± 0.12.
Литературные значения: рК1 = 1.25 и рК2 = 4.27.
Известные методы определения констант диссоциации двухосновных кислот дают конечные величины лишь после решения системы уравнений и константы иногда принимают отрицательные значения (в частности, для полиэлектролитов) или величины с большим разбросом. В рассмотренной методике все константы оцениваются непосредственно (табл. 4.2, две последние колонки) и могут быть математически обработаны напрямую.
