
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.2.1.3. Двухсайтовая модель связывания лигандов с рецептором PTH1R
N-концевые пептидные фрагменты ПТГ и ПТГрП являются достаточными для связывания и активации рецептора PTH1R в той же степени, что и нативные молекулы. У млекопитающих активация рецептора PTH1R доменами ПТГ (1–34) и ПТГрП (1–34) сравнима с активацией соответствующими полноразмерными протеинами (Moseley J.M., Gillespie M.T., 1995;
Blind E. et al., 1993). И ПТГ (1–34) и ПТГрП (1–34) одинаково эффективны для активации сигнализации цАМФ (Juppner H. et al., 1991). Их взаимодействие с рецептором происходит по «двухдоменной» схеме. Способ связывания лиганда, используемый и активации PTH1R, был установлен с использованием биохимических и мутационных методов, в которых используются различные мутантные рецепторы и измененные аналоги лиганда. Эти исследования дали значительные механистические идеи и вместе привели к так называемой «двухсайтовой» модели связывания ПТГ или ПТГрП с PTH1R (Hoare S.R et al., 2001; Castro M. et al., 2005). Согласно этой модели, С-концевой участок (15–34) фрагмента ПТГ (1–34) или ПТГрП (1–34) в α-спиральной конформации, представляющий основной связывающий домен, связывается с N-концевым участком внеклеточного домена рецептора для установления начальных стыковочных взаимодействий, а затем с N-концевой участок лиганда (1–14), содержащий основные детерминанты передачи сигналов, взаимодействует с трансмембранной частью рецептора, что приводит к конформационным изменениям, связанным с активацией рецептора и связыванием с гетеротримерными G-белками (Cheloha R.W. et al., 2015; de Graaf C. et al., 2017). Остатки 1–14 взаимодействуют с 7-м трансмембранным доменом, встроенным в мембрану, а остатки 15–34 взаимодействуют с N-концевым внеклеточным доменом рецептора (Bergwitz C. et al., 1996; Luck M.D. et al., 1999). Фрагменты ПТГ (1–14) и ПТГрП (1–14) имеют восемь идентичных аминокислотных последовательностей, отражающих критическую роль, которую этот фрагмент играет при активации рецептора (Luck M.D. et al., 1999), в то время как домены (15–34) имеют только три аминокислотные идентичности, несмотря на их критическую роль в придании связывания с высокой аффинностью к рецептору. Основные связывающие домены ПТГ и ПТГрП принимают аналогичные конформации, когда связываются с рецептором, что в значительной степени подтвержденос помощью последних кристаллографических исследований каждого из лигандов (Gardella T.J., Vilardaga J-P., 2015).
Модель двух сайтов, появившаяся в результате таких мутационных исследований, получила дальнейшую поддержку благодаря использованию методов фотоаффинного перекрестного сшивания, которые определялись прямыми физическими средствами, специфическими контактами между сайтами в лиганде и рецепторе. Двухсайтовая базовая модель в значительной степени подтверждается совокупными данными, представленными многочисленными мутационными и биохимическими исследованиями, которые сосредоточены на этой проблеме для PTHR1 (Shimizu M. et al., 2000; Hoare S.R. et al., 2001; Shimizu N. et al., 2001; Gensure et al., 2005; Wittelsberger et al., 2006). В конечном счете, любая такая модель должна соответствовать прямому физическому анализу комплексов лиганд-рецептор. Важные шаги в этом направлении и действительно открывают изображения с высоким разрешением, по крайней мере, некоторых конкретных участков контакта между лигандом и рецептором. В недавнем сообщении Ehrenmann J. et al., (2018) представили кристаллическую структуру высокого разрешения PTH1R в комплексе с пептидным агонистом Разрешение 2,5-A позволило разграничить режим связывания агониста для этого рецептора и выявления молекулярных деталей в пределах консервативных структурных мотивов, которые являются критическими для функции рецепторов этого класса. Последние технологические достижения в криоэлектронной микроскопии (крио-ЭМ) произвели революцию в структурной биологии GPCR, что привело к открытию серии прорывных структур, включая несколько GPCR класса A и класса B в комплексе с G-белками. Zhao L.H. et al. (2019) опубликовали результаты исследования структуры человеческого PTH1R, связанного с аналогом ПТГ пролонгированного действия и G-белком используя метод криоэлектронной микроскопии (рис. 5).
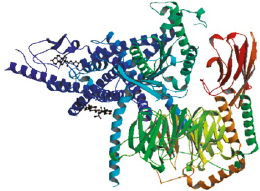
Рис. 5. Крио-ЭМ структура рецептора PTH1R в комплексе с длительно действующим аналогом паратиреоидного гормона и G-белком. PDB 6NBI (Zhao L.H., Ma S., Sutkeviciute I., Shen D.D., Zhou X.E., de Waal P.W., Li C.Y., Kang Y., Clark L.J., Jean-Alphonse F.G., White A.D., Yang D., Dai A., Cai X., Chen J., Li C., Jiang Y., Watanabe T., Gardella T.J., Melcher K., Wang M.W., Vilardaga J.P., Xu H.E., Zhang Y. Science. 2019; 364: 148-153)
Эта структура обеспечивает полное понимание того, как PTH1R взаимодействует с агонистическим пептидным лигандом и, кроме того, выявляет пролонгированное активное состояние PTH1R, которое поддерживает передачу сигналов эндосомным cAMP. Структура, представленная в этой статье, обеспечивает основу для систематизации обширного массива биохимических и мутационных данных, разработанных для PTH1R и позволяющих разрабатывать новые методы лечения заболеваний костей и нарушений минерального метаболизма, таких как остеопороз и раковая кахексия. Полученные данные подтверждают и расширяют двухсайтовую модель связывания лигандов PTH1R. Эти структуры показывают, что пептид связан в виде линейной α-спирали с его C-концевой частью, прикрепленной к внеклеточному домену, и его N-концевой частью, взаимодействующей с трансмембранным доменом.
Достигнуты важные успехи в получении структурной информации о PTH1R и о том, как он взаимодействует с пептидными лигандами ПТГ и ПТГрП. Серьезным прорывом стало определение в 2008 году Pioszak A.A. and Xu H.E. (2008) рентгенокристаллической структуры внеклеточного домена PTH1R в комплексе с пептидом ПТГ (12–34), который содержит основной связывающий домен лиганда
Было обнаружено, что способ связывания, наблюдаемый для ПТГрП, очень сходен с таковым для ПТГ, так что объединенные новые структурные данные полностью соответствуют и подтверждают предшествующие функциональные исследования, которые показали, что, несмотря на явное изменение последовательности, (15–34) домены ПТГ и ПТГрП связываются с одинаковыми или, по крайней мере, в значительной степени перекрывающимися сайтами в рецепторе (Juppner H. et al., 1988; Caulfield M.P. et al., 1990). Таким образом, кристаллическая структура показывает, что домен ПТГрП связывается с амфипатической α-спиралью лиганда с остатками Phe23, Leu24 и Ile28 вдоль одной спиральной поверхности, образуя обширные гидрофобные взаимодействия с остатками рецептора, выстилающими бороздку ECD (Pioszak A.A.et al., 2009).
внеклеточного домена и, таким образом, находится в оптимальном положении для внеклеточных взаимодействий и, может вызывать молекулярные события, приводящие к активации рецептора и трансмембранной передаче сигналов. Однако признается, что общий процесс связывания и активации лиганда в PTH1R все еще далек от полного понимания, и он, вероятно, намного сложнее, чем приписывается любому такому механизму, включая простую модель «двух сайтов». Утверждается, что необходимы дальнейшие исследования с использованием новых подходов и новых инструментов, чтобы более четко разъяснить ключевые этапы, которые определяют механизмы связывания и активации лигандов, действующие на PTHR1 (Gardella T.J., Vilardaga J.P., 2015).