
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.2.1.4. Сигнальные пути трансдукции рецептора PTH1R
Cвязывание рецепторов класса GPCR включая PTH1R с агонистом может активировать или угнетать многие цитоплазматические эффекторные протеины: анденилатциклазы 1–9, фосфолипазы С и В, тирозинкиназы, фосфоинозитид 3-киназу и ионные каналы (Cabrera-Vera T.M. et al., 2003).
Важной функциональной характеристикой семейства рецепторов, связанных с G-белком, является их способность активировать более одного каскада вторичных мессенджеров. Активация вторичных эффекторов в цепи биохимических событий вдоль сигнального пути также была продемонстрирована для ряда рецепторов, (Zhu X. et al., 1994), но доказательства того, что двойная передача сигналов происходит в нативных тканях, очень сильны для рецепторов семейства секретина и особенно убедительны для PTH1R (Chorev M., 2002; Gensure R.C. et al., 2005).
Большой N-концевой экзодомен рецептора PTH1R участвует во взаимодействии с лигандами, а С-концевой домен отвечает за активизацию внутриклеточного сигнального каскада (Cardoso J.C. et al., 2006; Gardella T.J., Juppner H., 2001; Juppner H. et al., 1991; Harmar A.J., 2001). Рецептор PTH1R связывается c N-концевыми доменами ПТГ (1–34) и ПТГрП (1–36), активирует аденилатциклазный-протеинкиназный А, либо фосфолипазный-протеинкиназный С внутриклеточные сигнальные пути (Abou-Samra A.B. et al., 1989; Zuscik M.J. et al., 2002; Li T.F. et al., 2004) Посредством этих сигнальных путей ПТГрП стимулирует накопление внутриклеточных вторичных мессенджеров, таких как цАМФ, диацилглицерин и инозитолтрифосфат, что впоследствии приводит к активации протеинкиназы A, протеинкиназы C и высвобождению внутриклеточного Ca2+ соответственно (рис. 6). (Abou-Samra A.B. et al., 1992). Это может индуцировать последующие эффекты, включая фосфорилирование белка, связывающего элемент реакции cAMP (CREB) и фосфорилирование внеклеточных сигнальных киназ (ERK1/2) (Cupp M.E. et al., 2013; Datta N.S. et al., 2010). Также было показано, что ПТГрП может активировать ERK1/2 после внутриклеточной интернализации PTH1R, в зависимости от бета-аррестинов (Sneddon W.B., Friedman P.A., 2007; Gesty-Palmer D. et al., 2006; Syme C.A. et al., 2005).
Активированный PTH1R инициирует каскад внутриклеточных процессов, главным образом, посредством передачи сигналов через α-субъединицу стимулирующего G-белка Gs (Schwindinger W.F. et al., 1998), что, в свою очередь, приводит к синтезу цАМФ и активации протеинкиназы А (Segre G.V. et al., 1992). PTH1R также может передавать сигналы через Gq, тем самым активируя фосфолипазу C (Friedman P.A. et al., 1999), повышая внутриклеточный уровень инозитолтрисфосфата и внутриклеточных ионов кальция (Tanaka H. et al., 1995). Кроме того, передача сигналов PTH1R через митоген-активируемый протеинкиназный путь была показана в нескольких тканях (Chan G.K. et al., 2001; Miao D.et al., 2001) (рис. 6).
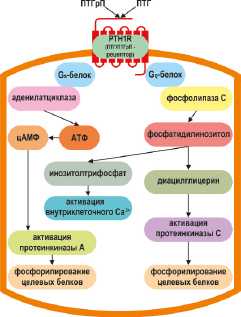
Рис. 6. Трансдукции сигнального пути в лиганд-индуцированной активации рецептора PTH1R. Связывание лиганда приводит к ассоциации с Gs α-субъединицы G-белка и активации аденилатциклазы, или с Gq α-субъединицы G-белка, который активирует фосфолипазу С. ПТГрП проявляет большую вариабельность в отношении эффектов на клетки – мишени запуская в них различные механизмы внутриклеточной передачи сигнала, активируя или угнетая ряд цитоплазматических эффекторных протеинов, а также индуцируя внутриклеточный Са2+-сигнал через транзиторное открытие каналов L типа Са2+
Показано, что PTH1R опосредует трансмембранную сигнальную трансдукцию, связываясь с G-белками, а затем полностью изменяет процесс терминации сигнала. Было идентифицировано несколько остатков в частях рецептора, которые подвергаются воздействию цитоплазматического домена, что при мутировании приводит к изменениям в передаче сигналов G-белка. Вероятно, есть много других остатков во внутриклеточных петлях и на внутриклеточных концах спиралей трансмембранного домена, которые способствуют связыванию G-белка, но они остаются в значительной степени неопределенными. Что касается механизмов терминации сигнала в PTH1R, ряд исследований показал, что этот процесс в значительной степени опосредуется фосфорилированием рецептора через киназы рецептора G-белка, последующим рекрутированием белков β-аррестина и затем интернализацией рецептора. Фактически, стимуляция PTH1R может приводить к активации митоген-активируемого пути протеинкиназы с помощью G-белок-независимой передачи сигналов бета-аррестина (Gesty-Palmer D. et al., 2006). Кластер из семи сериновых остатков, расположенный в средней части цитоплазматического хвоста, является участком лиганд-индуцированного фосфорилирования рецептора и служит для регуляции взаимодействия активированного PTH1R с белками аррестина и, следовательно, интернализации рецептора и десенсибилизации сигнального пути Gq (Malecz N. et al., 1998; Tawfeek H.A. et al., 2002; Vilardaga J.P. et al., 2002; Rey A. et al., 2006; Maeda A. et al., 2013).
ПТГрП имитирует почти все функции ПТГ, которые опосредованы взаимодействием N-терминального домена с рецептором и последующей активацией внутриклеточных сигнальных путей. ПТГ и ПТГрП активируют передачу сигналов рецептора PTH1R, но только ПТГ поддерживает продукцию 3′, 5′-циклического монофосфата (цАМФ), вызванную GS, после интернализации PTH1R в ранние эндосомы. Механизм такого поведения рецептора, связанного с G-белком, до конца не изучен.
В некоторых тканях ПТГрП также связывается с рецептором, который не связывает ПТГ. В одних и тех же клетках могут присутствовать рецептор, взаимодействующий с ПТГрП (1–36) и другой рецептор, лигандом которого является ПТГрП (67–86) (Orloff J.J. et al., 1996). Предполагается связывание фрагментов (1–14) и (15–34) домена ПТГрП (1–34) с рецептором PTH1R и прямым или косвенным участием His-5, Arg-19 иArg-21 в этом взаимодействии (Gardella T.J. et al., 1995). Установлено, что COOH-концевой домен человеческого ПТГрП (1–34) участвует в связывании рецепторов, тогда как NH2-терминальный домен Ala-1-Ser-14 инициирует каскад передачи сигналов (Botella A. et al., 1994). Предполагается, что первоначальное связывание рецептора с СООН-концевым фрагментом облегчает взаимодействие рецептора с NH2-концевой спиралью. Взаимодействие между двумя спиралями белка может быть необходимым для реализации биологической активности и может быть индуцировано при связывании рецептора (Gardella T.J. et al., 1995). В виду множественных функций ПТГрП, опосредованных его NH2-терминальным фрагментом (1–34), определение третичной структуры этого белка представляет значительный биохимический и медицинский интерес. Аналоги нативных лигандов рецептора PTH1R, такие, как ПТГ (3–34), ПТГ (7–34), [Phe3] и [Phe6] ПТГ, [D-Trp12, Tyr34], ПТГ (7–34), ПТГрП (7–34), [D-Trp12] ПТГрП (7–34), [Asn10, Leu11] ПТГрП (7–34), [Asn10, Leu11, D-Trp12] ПТГрП (7–34), [Ile5, Trp23] ПТГрП (1–36), TIP (7–39) и TIP (9–39) связываются с этим рецептором с высокой аффинностью, но вызывают незначительную сигнальную трансдукцию, действуя как сильные антагонисты (Jonsson K.B. et al., 2001; Nutt R.F. et al., 1990; Pizurki L. et al., 1990; Carter P.H. et al., 1999; Cohen F.E. et al., 1991). Функциональное тестирование с использованием усеченных форм ПТГрП показало, что эти пептиды не смогли вызвать синтез цАМФ, но могли стимулировать фосфолипазу C. Таким образом, первые несколько остатков имеют важное значение для пути cAMФ, но не для связывания рецептора (Rotllant J. et al., 2005). Эти свойства усеченного ПТГрП (7–34) использовали для развития антагонистов рецептора PTH1R (Gardella T.J. et al., 1996). ПТГ (1–31) и ПТГ (1–28) являются самыми короткими нативными пептидами, которые поддерживают полную аффинность рецепторов и мощность сигнала (Whitfield J.F., Morley P., 1995; Whitfield J.F., Bringhurst F.R., 2000), тогда как ПТГ (1–14) является самым коротким нативным N-концевым пептидом, для которого существует некоторая агонистическая активность (Luck M.D. et al., 1999). Остатки в позициях 1–9 образуют ключевой домен активации рецептора, а аминокислотные замены в этих положениях повышают эффективность до 25 раз, а также активируют неактивный нативный пептид ПТГ (1–11) (Shimizu M. et al., 2000). Многогранность эффектов ПТГрП связана с его способностью взаимодействовать с несколькими типами рецепторов. ПТГрП (107–139) может активировать сигнальные пути через протеинкиназу С. (De Gortazar A.R. et al., 2006). Это рассматривается как свидетельство того, что срединный (midregion) и С-концевой домены ПТГрП связываются с другими типами рецепторов, которые еще не идентифицированы и не клонированы (Orloff J.J. et al., 1994). Тот факт, что COOH-концевые области ПТГ и ПТГрП имеют функции отличающиеся от тех, которые опосредованы известными рецепторами PTH1R, предполагает, что для этих фрагментов могут существовать другие рецепторы (Gensure R.C. et al., 2004).
ПТГрП проявляет большую вариабельность в отношении эффектов на клетки – мишени запуская в них различные механизмы внутриклеточной передачи сигнала (Abou-Samra A.B. et al., 1992). ПТГрП способен индуцировать внутриклеточный Са2+-сигнал через транзиторное открытие каналов L типа Са2+, тем самым влияя на экспрессию генов, промотеры которых содержат Са2+ -реагирующие элементы и/или другие внутриклеточные пути, зависящие от Са++-кальмодулина (Alokai M.S., 2007; Valin A. et al., 2001; Whitfield J.F., 2007) (рис. 6). С использованием серии биохимических и клеточных биологических подходов, показано, что внеклеточный Ca2+ связывается с первой внеклеточной петлей рецептора и действует как положительный аллостерический модулятор передачи сигналов PTH1R, увеличивая время пребывания лиганда на рецепторе и усиливая устойчивую продукцию цАМФ (White A.D. et al., 2019). В совокупности эти результаты демонстрируют, что внеклеточный Ca2+ действует как положительный аллостерический модулятор PTH1R, продлевая время пребывания лиганда и активацию рецептора, что, в свою очередь, значительно меняет величину и кинетику ответа цАМФ. В целом, эти результаты свидетельствуют о фундаментальной роли внеклеточного Ca2+ в передаче сигналов PTH1R. Возможный вклад аллостерии Ca2+ в физиологическую функцию PTH1R может иметь место во время общепризнанного катаболического действия ПТГ, которое индуцирует высвобождение Ca2+ из кости посредством стимуляции резорбции кости. Увеличение местного Ca2+ в микроокружении костей может обеспечить петлю положительной обратной связи, способствующую гомеостазу кальция через систему ПТГ/PTH1R (White A.D. et al., 2019).
Длительные сигнальные ответы цАМФ, которые во времени коррелируют с объемной интернализацией комплексов лиганд-рецептор, также положительно коррелируют со способностью данного лиганда ПТГрП (1–36) связываться с высокой аффинностью к R0 конформацией PTH1R. Эти результаты позволили предположить, что PTH1R может опосредовать сигнальные ответы цАМФ как каноническими механизмами, действующими на плазматической мембране, так и неканоническими механизмами, которые действуют изнутри интернализованного эндосомального домена (Dean T. et al., 2006, 2008; Okazaki M. et al., 2008; Ferrandon S. et al., 2009; Feinstein T.N. et al., 2011).
Многие исследования действительно подтвердили механизмы быстрой регуляции сигнала и десенсибилизации для PTHR1, которые включают фосфорилирование рецепторов и аррестин-зависимую интернализацию (Vilardaga J.P. et al., 2001; Tawfeek H.A. et al., 2002; Tawfeek H.A. and Abou-Samra A.B., 2004; Rey A. et al., 2006; Sneddon W.B. and Friedman P.A., 2007). Устойчивая передача сигналов цАМФ опосредованная интернализованным PTH1R, связанным с R0-селективными лигандами объясняется особым способом действия, опосредованным лиганд-рецепторными комплексами, которые локализованы в эндосомальном домене (Ferrandon S. et al., 2009; Vilardaga J.P. et al., 2012; 2014). Одним из ключевых результатов в поддержку этой модели является обнаружение того, что коэкспрессия ингибирующей (доминантно-негативной) формы динамина, белка, который способствует интернализации везикул, привела к сокращению продолжительности передачи сигналов cAMP, индуцированной ПТГ (1–34) в PTH1R (Ferrandon S. et al., 2009; Gidon A. et al., 2014).
Полагают, что длительная передача сигналов, опосредованная G-белком через интернализованные комплексы, является механизмом передачи сигналов, который используется более широко в обширном суперсемействе GPCR (Irannejad R. and von Zastrow M., 2014; Vilardaga J.P. et al., 2014).