
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.2.1.5. Селективность взаимодействия лигандов для различных конформаций рецептора PTH1R
Поскольку PTHR1 может передавать сигналы по нескольким путям, лиганды, которые избирательно активируют один путь, но не другие, могут помочь в определении того, какие сигнальные пути способствуют биологическим реакциям, индуцируемым лигандами PTH1R в клетках-мишенях. Общая концепция предвзятого агонизма основана на представлении о том, что GPCR могут принимать множество конформаций и, следовательно, обладают плейримерной способностью опосредовать измененные способы распознавания лигандов и передачи сигналов (Clarke W.P., 2005; Reiter E. et al., 2012; Luttrell L.M., 2014).
В соответствии с существующими представлениями о GPCR, PTH1R считается конформационно-динамическим и, таким образом, обладает способностью находиться в различных конформационных состояниях, любое из которых может быть связано и стабилизировано определенным аналогом лиганда, и, следовательно, может активировать определенную программу цитоплазматических сигнальных событий. Результаты исследований с использованием фармакологических и биофизических подходов, подтверждают эту концепцию и, таким образом демонстрируют, как стабилизация лиганда при различных конформационных состояниях PTH1R может приводить к различным типам биологических реакций. Показано, что PTH1R может образовывать высокоаффинные комплексы с определенными лигандами, включая ПТГ (1–34), даже в отсутствие связывания с G-белком, поскольку комплексы остаются стабильными в присутствии GTPγS, который индуцирует диссоциацию комплекса рецептор-G белок (Dean T. et al., 2006). Напротив, другие агонистические лиганды, такие как ПТГрП (1–36), образуют комплексы, которые быстро диссоциируют в присутствии GTPγS.
Несмотря на общий механизм связывания двухдоменных рецепторов, сходную вторичную структуру и эквипотентную активацию сигнализации, ПТГ и ПТГрП отличаются способностью связываться с двумя физиологически и биохимически различными версиями рецептора PTH1R, которые отличаются наличием или отсутствием связывания с G белком (Sutkeviciute I. et al., 2019; Okazaki M. et al., 2008).
Предполагается, что PTH1R обладает способностью образовывать уникальную высокоаффинную конформацию, называемую R0 и эта конформация не зависит от связывания с G-белком. Лиганды также связываются с высоким сродством с рецептором, связанным с белком G (конформационное состояние RG). В то время как ПТГ (1–34) может образовывать стабильные комплексы с R0, ПТГрП (1–36), связывается с высокой аффинностью только с конформацией рецептора RG, связанного с G-белком, что более соответствуют классическим механизмам связывания лигандов в GPCR (Dean T. et al., 2006, 2008).
В отсутствие связи G-белка (конформационное состояние R0) связывание ПТГрП уменьшается, тогда как связывание ПТГ лишь незначительно уменьшается (Dean T. et al., 2008; Dean T. et al., 2006; Hoare S. et al., 2001). Таким образом, ПТГрП более RG-селективен, чем ПТГ. Различные профили селективности R0/RG рецепторов с ПТГ и ПТГрП коррелируют с различными временными эффектами на сигнализацию цАМФ. ПТГ вызывает более длительный сигнал цАМФ после лиганд-рецепторного взаимодействия, чем ПТГрП (Dean T. et al., 2008). Дивергентный остаток 5 (Ile в ПТГ, His в ПТГрП) является ключевым определителем различий селективности взаимодействия лигандов с R0/RG конформациями рецептора (Dean T. et al., 2008; Hoare S.R. et al., 2001). ПТГ и ПТГрП демонстрируют различную селективность для двух различных конформаций PTH1R, но то, как их связывание с рецептором отличается, неясно. Кристаллическая структура высокого разрешения ПТГрП, связанная с внеклеточным доменом PTHR1, показывает (рис. 7), что ПТГрП связывается как амфипатическая альфа-спираль с той же гидрофобной канавкой в внеклеточным домене, что и ПТГ, но в отличие от прямой непрерывной спирали ПТГ, спираль ПТГрП мягко изогнута и C-терминально «размотана».
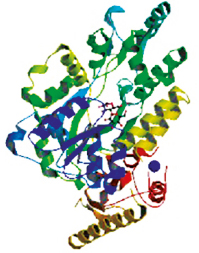
Рис. 7. Кристаллическая структура внеклеточного домена рецептора PTH1R в комплексе с белком, родственным паратиреоидному гормону (ПТГрП). PDBe > 3h3g. (Pioszak A.A., Parker N.R., Gardella T.J., Xu H.E. J Biol Chem.
2009; 284: 28382-28391)
Рецептор вмещает измененные режимы связывания путем смещения конформаций боковых цепей двух остатков в канавке связывания: Leu-41 и Ile-115, причем первый действует как поворотный переключатель для размещения расхождения ПТГ/ПТГрП, а последний адаптируется к кривизне ПТГрП (Pioszak A.A. et al., 2009).
ПТГ и ПТГрП демонстрируют различные режимы связывания с внеклеточным доменом PTH1R. В обоих случаях гидрофобная грань амфипатического пептида связывает гидрофобную бороздку в внеклеточном домене, и взаимодействие фиксируется инвариантными остатками Arg-20′ и Leu-24′. Наиболее заметные различия наблюдаются на С-концах пептидов. ПТГ образует непрерывную α-спираль от Leu-15′ до Phe-34′, где С-концевая амидная группа образует важные водородные связи с внеклеточным доменом рецептора. Напротив, спираль ПТГрП простирается от Ile-15′ до Ile-31′, после чего она «раскручивается», и С-концевая амидная группа не участвует в связывании рецептора (Pioszak A.A. et al., 2009). Оба лиганда PTH1R проявляют сходное сродство к внеклеточныму домену, возможно, из-за дополнительных водородных связей, образованных остатками 32–34 ПТГрП. Рецептор приспосабливает различные способы связывания этих двух лигандов с тонкими, но четко различимыми изменениями в локальной конформации. Таким образом, сайт связывания внеклеточного домена рецептора проявляет пластичность, обеспечивая различные способы связывания ПТГ и ПТГрП путем изменения конформации остатков
Leu-41 и Ile-115. Спектроскопические кинетические данные полностью, подтверждают гипотезу, что ПТГ (1–34) и ПТГрП (1–36) связываются преимущественно с различными конформациями PTHR и что остаток лиганда 5 играет важную роль в селективности взаимодействия лигандов с различными конформациями рецептора (Dean T. et al., 2008).
Хотя стабильное связывание с R0, по-видимому, не требует прямого связывания с G-белком, функциональное следствие такого связывания заключается в том, что ответный сигнал cAMP, опосредованный такими лигандами, является пролонгированным. Одно из объяснений наблюдаемых корреляций между стабильным связыванием с R0 и длительными ответными реакциями на передачу сигнала цАМФ заключается в том, что комплекс R0 может изомеризироваться в биологически активную конформацию RG и, возможно, делать это многократно без высвобождения связанного агонистического лиганда. В этом отношении комплекс лиганд-PTH1R (R0) вовлекает и активирует гетеротримеры G-белка через каталитически-подобный механизм (Rodbell M., 1997; Dean T. et al., 2008).
Предполагается, что длительные ответы на аналоги лигандов, наблюдаемые in vivo, связаны не просто с длительным периодом полужизни пептидов в кровообращении, а скорее с постоянным связыванием лигандов с PTH1R в клетках-мишенях. Из-за их пролонгированного действия in vivo такие R0-селективные аналоги в настоящее время исследуются в качестве потенциальных новых препаратов для лечения пациентов с гипопаратиреозом (Shimizu M. et al., 2008; Mannstadt M. et al., 2013). Степень, в которой способность связываться с R0конформацией PTH1R опосредует длительную передачу сигналов, и, следовательно, определяет общий профиль биологического ответа, индуцированного эндогенным ПТГ или ПТГрП, в настоящее время неясна, отчасти потому, что ключевые исследования до сих пор проводились в основном с усеченными и модифицированными вариантами ПТГ и ПТГрП, а также потому, что остается некоторая неопределенность в отношении точных форм эндогенных лигандов ПТГ и ПТГрП, которые действуют на PTH1R в тканях-мишенях.
Не совсем понятно, объясняют ли различные способности связываться с состоянием R0рецептора какие-либо различия в фармакологических или физиологических эффектах ПТГ и ПТГрП. Стабилизация или формирование отличительных конформаций PTH1R, которые различаются по продолжительности передачи сигналов, может быть одним из факторов, которые частично лежат в основе различных способов действия. Более короткая продолжительность передачи сигналов может быть полезным механизмом для паракринного фактора, участвующего в определении времени программ дифференцировки клеток. Пептид ПТГрП (1–36) в ограниченных исследованиях на людях, о которых сообщалось до сих пор, похоже, отличается от ПТГ (1–34) по степени гиперкальциемии, вызванной после однократной инъекции подкожно (Horwitz M.J. et al., 2006), стимуляци выработки 1,25-(OH)2 витамина D3 после внутривенной инфузии (Horwitz M.J. et al., 2005) и стимуляции резорбции кости после нескольких месяцев ежедневного введения подкожно (Horwitz M.J. et al., 2003). Различия в способности лигандов ПТГ и ПТГрП связываться с конформацией R0 PTH1R объясняют некоторые из этих различных фармакологических эффектов лигандов и могут быть полезны для изучения в терапевтических целях.
Высокая корреляция аффинности внеклеточного домена PTH1R к ПТГ и ПТГрП с их селективностью к R0 и RG конформациям рецептора имеет важное значение при разработке аналогов ПТГ и ПТГрП для использования в качестве фармпрепаратов. Исследования аналогов ПТГ показали, что относительная способность лиганда связываться с конформацией рецептора R0 коррелирует с продолжительностью реакций метаболизма кальция и фосфата, индуцированных у животных, а также с суммарным влиянием на обмен костной ткани (Okazaki M. et al., 2008). ПТГрП, который является более селективным по отношению к RG конформации PTH1R, по-видимому, в большей мере является чисто анаболическим агентом, чем ПТГ, с меньшими побочными эффектами (Plotkin H. et al., 1998) и, таким образом, может иметь более благоприятные свойства в плане терапевтического применения, так как это позволяет избежать длительной передачи сигналов и, следовательно, костно-резорбтивного эффекта, наблюдаемого при воздействии PTH1R-R0-селективных аналогов ПТГ (Okazaki M. et al., 2008). Интригующим фармакологическим открытием является то, что PTH1R может образовывать удивительно стабильные комплексы с определенными аналогами ПТГ и ПТГрП и тем самым опосредовать продолжительные клеточные сигнальные ответы, которые сохраняются даже тогда, когда основная масса комплексов обнаруживается в интернализованных везикулах. Таким образом, PTH1R, по-видимому, способен активировать сигнальный путь Gαs /cAMP не только из плазматической мембраны, но также из эндосомального домена (Gardella T.J., Vilardaga J-P., 2015).